La miopia è una delle principali cause di disabilità visiva nel mondo. Negli ultimi due decenni questa patologia ha avuto una prevalenza quasi pandemica, registrando nel 2000 circa 1.406 miliardi di casi (22,9% della popolazione globale), dei quali il 2,7% presentava un grado di miopia elevata (-6,00 diottrie o peggio). Si prevede che la prevalenza mondiale di miopia aumenterà sino al 49,8% entro il 2050.
Nonostante la possibilità di correzione, la miopia resta comunque una patologia preoccupante, in quanto rappresenta il fattore di rischio dominante per alcune malattie oculari come la maculopatia miopica, il distacco della retina, il glaucoma e la cataratta. Per ciascuna di queste condizioni, il rischio aumenta all’aumentare del grado di miopia. Pertanto, esiste un bisogno urgente di definire la patogenesi alla base dell’insorgenza della malattia e di sviluppare interventi terapeutici efficaci e sicuri per la prevenzione delle complicanze ad essa associate.
La miopia è determinata da un eccessivo allungamento assiale dell’occhio che fa sì che la retina si trovi dietro il piano focale, questo cambiamento è accompagnato dal diradamento della sclera, atta a mantenere la forma e l’integrità oculare. Vari studi hanno indagato i meccanismi alla base del diradamento e dell’indebolimento della sclera miopia-correlate, tra questi alcuni hanno dimostrato un ruolo del rimodellamento della matrice extracellulare (ECM) sclerale legato alla sintesi decelerata ed alla degradazione accelerata dei componenti dell’ECM. Per esempio, in fase di insorgenza della miopia, il turnover del collagene di tipo I (il principale componente della ECM sclerale) aumenta a causa della down-regolazione della sua sintesi e ad un aumento della sua degradazione, portando ad un cambiamento dell’ECM sclerale. Nonostante tali intuizioni e numerosi modelli sperimentali, i segnali fisiologici che innescano questi cambiamenti rimangono ancora ignoti. Alcuni studi genetici e farmacologici hanno ipotizzato il coinvolgimento, nello sviluppo della miopia, di diversi segnali molecolari, tra cui: acido retinoico, acetilcolina, dopamina retinica, segnalazione mediata dal recettore TGF-? sclerale e recettori A2A per l’adenosina. In tutti i casi la natura dei mediatori di comunicazione tra retina e sclera rimane sconosciuta. L’analisi molecolare dei meccanismi alla base del rimodellamento sclerale non è semplice, non esiste infatti un metodo per affrontare l’eterogeneità cellulare dei tessuti sclerali. La sclera dei mammiferi è composta da un singolo strato fibroso di tessuto connettivo contenente fibroblasti e miofibroblasti. I primi secernono il collagene di tipo I, che è il componente principale delle fibre di collagene e di altri componenti dell’ECM, mentre i miofibroblasti sono cellule contrattili che derivano dalla trans-differenziazione graduale dei fibroblasti. Isolare ed analizzare ciascuno di questi diversi tipi di cellule sclerali, al fine di identificare i possibili mediatori del segnale che attivano il rimodellamento sclerale della ECM e lo sviluppo della miopia, è sperimentalmente difficile.
In questo studio, gli autori hanno utilizzato il sequenziamento dell’RNA a singola cellula (scRNA-seq) per identificare i distinti profili di espressione delle popolazioni cellulari della sclera al fine di fare luce sui cambiamenti fenotipici cellulari (cioè la trans-differenziazione fibroblasti/miofibroblasti) e sulle alterazioni dell’ECM durante la patogenesi della miopia.
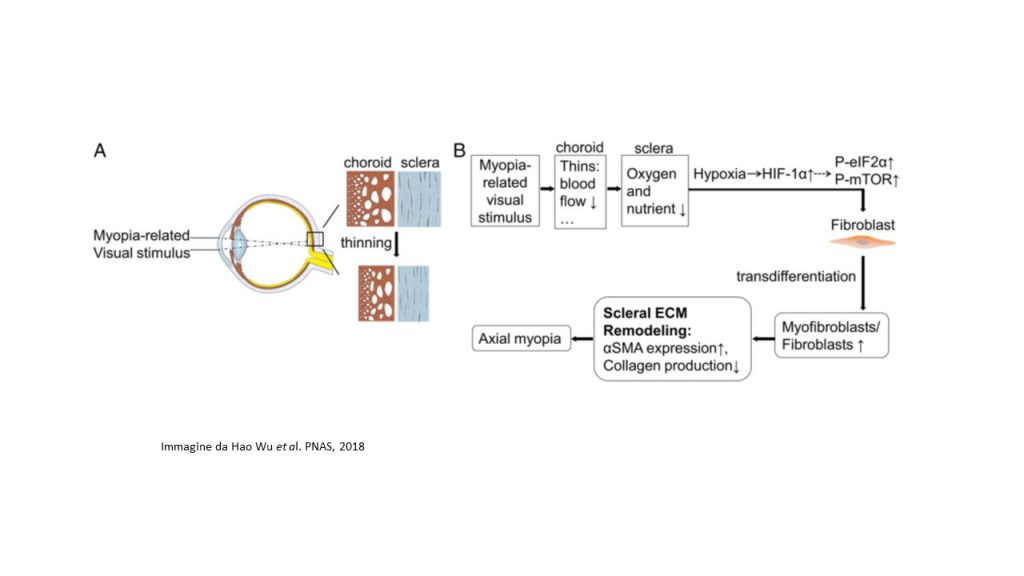 Lo studio pubblicato recentemente su PNAS, ha evidenziato che, nella sclera miopica dei modelli murini, i segnali di ipossia, ossia i pathways eIF2 (Eukaryotic Initiation Factor 2) e mTOR (mammalian target of rapamycin), venivano attivati. Gli autori, con molteplici linee di evidenza sperimentale stabiliscono che l’ipossia sclerale rappresenta un fattore critico che contribuisce allo sviluppo della miopia. In primo luogo, l’analisi di scRNA-seq ha rivelato che lo sviluppo della miopia è associato alla trans-differenziazione dei fibroblasti in miofibroblasti, le cui principali differenze funzionali derivano dall’attivazione di vie correlate all’ipossia (pathways di segnalazione eIF2 e mTOR). Molti geni coinvolti nel pathway di segnalazione del fattore ipossia-inducibile HIF-1? (Hypoxia-inducible factor 1-alpha) venivano, inoltre, associati a geni di rischio coinvolti nella miopia umana o nella miopia patologica.
Lo studio pubblicato recentemente su PNAS, ha evidenziato che, nella sclera miopica dei modelli murini, i segnali di ipossia, ossia i pathways eIF2 (Eukaryotic Initiation Factor 2) e mTOR (mammalian target of rapamycin), venivano attivati. Gli autori, con molteplici linee di evidenza sperimentale stabiliscono che l’ipossia sclerale rappresenta un fattore critico che contribuisce allo sviluppo della miopia. In primo luogo, l’analisi di scRNA-seq ha rivelato che lo sviluppo della miopia è associato alla trans-differenziazione dei fibroblasti in miofibroblasti, le cui principali differenze funzionali derivano dall’attivazione di vie correlate all’ipossia (pathways di segnalazione eIF2 e mTOR). Molti geni coinvolti nel pathway di segnalazione del fattore ipossia-inducibile HIF-1? (Hypoxia-inducible factor 1-alpha) venivano, inoltre, associati a geni di rischio coinvolti nella miopia umana o nella miopia patologica.
Il team di ricercatori ha anche evidenziato che l’esposizione all’ipossia (5% O2) promuoveva la trans-differenziazione miofibroblastica con down-regolazione del collagene di tipo I nei fibroblasti sclerali umani. Un altro importante aspetto emerso dallo studio è che, nelle cavie, l’uso di composti anti-ipossia, come salidroside e formononetina, down-regolava HIF-1?, nonché i livelli di fosforilazione di eIF2? e mTOR, rallentando così la progressione della miopia sperimentale, senza alterare la normale crescita oculare. Inoltre, l’inibizione della fosforilazione di eIF2? sopprimeva la miopia indotta sperimentalmente, mentre la fosforilazione di mTOR induceva la miopia nei modelli murini sani.
Nel loro complesso i risultati di questo studio hanno definito un ruolo essenziale dell’ipossia nel rimodellamento della ECM sclerale e nello sviluppo della miopia. L’identificazione dell’ipossia sclerale nella miopia contribuisce non solo a comprendere i meccanismi dello sviluppo della miopia, ma suggerisce anche un approccio terapeutico praticabile per controllare la progressione della miopia negli esseri umani.
Fonte
Scleral hypoxia is a target for myopia control. Hao Wu et al. Proceedings of the National Academy of Sciences (PNAS). Jul 2018.
Dr. Carmelo Chines
Direttore responsabile
