Promettenti risultati dagli studi di fase 3 del Faricimab, anticorpo monoclonale, che in base ai dati già presentati risulta efficace nel ridurre l'edema maculare e consentire un allungamento degli intervalli di somministrazione intravitreale.
Le occlusioni venose retiniche (Retinal Vein Occlusions – RVO) costituiscono, dopo la retinopatia diabetica, il disordine retinico vascolare più comune e colpiscono oltre 28 milioni di persone nel mondo, con una incidenza uniforme tra i due sessi. Le RVO rappresentano una causa comune di perdita visiva nella popolazione anziana, con un’incidenza a 10 anni di 1,6% nella popolazione di età ≥ 49 anni.
Solitamente le RVO insorgono dopo i 60 anni d’età e determinano spesso una perdita della vista improvvisa e indolore, causata dall’ostruzione venosa che limita il normale afflusso del sangue alla retina, provocando ischemia, emorragia, fuoriuscita e accumulo di liquido e quindi, edema maculare.
La diagnosi e la gestione delle RVO sono radicalmente cambiate negli ultimi 30 anni, ma rimane tuttora di importanza cruciale la diagnosi precoce dell’ischemia a livello maculare.
Classificazione e fattori di rischio
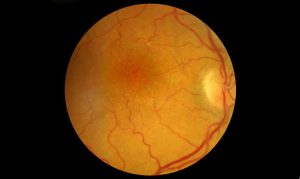 Esistono due forme di RVO: l’occlusione venosa retinica di branca (BRVO), che è l’occlusione di una branca della vena centrale e costituisce il 70% delle RVO, e l’occlusione della vena centrale della retina (CRVO), che rappresenta il restante 30% dei casi. Nell’ambito delle RVO bisogna poi distinguere tra la forma non-ischemica (perfusa), e quella ischemica (non perfusa).
Esistono due forme di RVO: l’occlusione venosa retinica di branca (BRVO), che è l’occlusione di una branca della vena centrale e costituisce il 70% delle RVO, e l’occlusione della vena centrale della retina (CRVO), che rappresenta il restante 30% dei casi. Nell’ambito delle RVO bisogna poi distinguere tra la forma non-ischemica (perfusa), e quella ischemica (non perfusa).
I principali fattori di rischio sono l’età (soprattutto per la BRVO), l’ipertensione, il diabete, la dislipidemia, il fumo di sigaretta, le patologie cardiovascolari, l’iperviscosità ematica e le patologie renali. Ulteriori fattori di rischio di natura prettamente oculare sono il glaucoma o l’ipertono oculare (soprattutto per la CRVO).
Più di un secolo fa, nel 1856, Virchow aveva già identificato i tre principali fattori coinvolti nella patogenesi dei trombi oculari (Triade di Virchow):
– fattori meccanici, legati ad alterazioni del flusso sanguigno, stasi o turbolenza, che possono essere dovute a compressioni vascolari, aterosclerosi o crisi emodinamiche distrettuali. A livello oculare la stasi ematica può essere facilitata dall’ipertensione oculare e dall’ipotensione arteriosa.
– alterazioni dell’endotelio vasale, che possono essere dovute a processi infiammatori, traumatici, dismetabolici (diabete, dislipemie, ecc.), all’ipertensione arteriosa o all’aterosclerosi.
– alterazioni dello stato di coagulabilità del sangue (ipercoagulabilità ematica), che possono essere una condizione genetica e/o acquisita.
I processi infiammatori giocano un ruolo chiave in tutte le fasi che caratterizzano il fenomeno occlusivo, concorrendo al danno endoteliale, al mantenimento e all’autoalimentarsi dei processi che portano alla formazione del trombo e al determinismo delle conseguenze più evidenti dell’occlusione vascolare, quali le alterazioni di natura ischemica e l’edema maculare.
Novità terapeutiche
Le nuove tecniche di imaging hanno proiettato nuova luce sui meccanismi fisiopatologici di questa patologia e il trattamento laser, che un tempo costituiva la sola opzione terapeutica, costituisce adesso solo uno dei possibili approcci, che includono la somministrazione intravitreale di farmaci anti-VEGF o di steroidi, che costituiscono attualmente i trattamenti di prima scelta nella maggior parte dei casi.
Indubbiamente oggi gli esiti visivi a lungo termine sono di gran lunga migliori di quelli prevedibili 20 anni fa, purtroppo però in alcuni casi si sviluppano delle complicanze che pregiudicano la vista e che richiedono un approccio più aggressivo, talvolta chirurgico.
Sono attualmente in sviluppo nuove opzioni terapeutiche, che includono anche la terapia genica, ma la novità più interessante che arriva dalla ricerca riguarda un anticorpo monoclonale, il faricimab, che somministrato con iniezione intravitreale potrebbe far estendere fino a quattro mesi l’intervallo di trattamento per l’edema maculare dovuto all’occlusione venosa retinica di branca e centrale e che al momento attuale viene gestito con terapie mensili o bimestrali.
Gli anticorpi monoclonali sono prodotti in laboratorio, costruiti partendo da un singolo clone di un linfocita B (da cui l’aggettivo “monoclonale”), il che assicura che ogni anticorpo così ottenuto riconosca una sola, specifica porzione dell’antigene che, in precedenza, era stato iniettato in animali da laboratorio. Una volta che un animale inoculato ha iniziato a produrre gli anticorpi diretti contro l’antigene, i linfociti B immagazzinati all’interno della sua milza vengono fusi con cellule estremamente resistenti, a formare quelli che vengono chiamati ibridomi. Questo passaggio assicura la sopravvivenza e la capacità dei linfociti di replicarsi praticamente all’infinito.
Faricimab, in particolare, è il primo anticorpo bispecifico approvato per uso oculare, studiato per colpire ed inibire due vie metaboliche connesse alle patologie retiniche: l’angiopoietina 2 (Ang-2) e il fattore di crescita endoteliale vascolare A (VEGF-A).
Attualmente Faricimab è oggetto di due studi clinici di fase 3, Balaton e Comino, presentati il 3 febbraio durante il convegno Angiogenesis, Exudation, and Degeneration 2024, organizzato dal Bascom Palmer Eye Institute in Florida, negli Stati Uniti.
In base ai dati presentati in anteprima, faricimab ha dimostrato di essere efficace sia in pazienti con BRVO che in pazienti con CRVO nel migliorare la BCVA (Best Corrected Visual Acuity) ) e nel ridurre l’entità dell’edema maculare, misurato dallo spessore retinico centrale. I risultati mostrano, inoltre, che il 60% dei pazienti con BRVO e il 48% di quelli con CRVO possono estendere gli intervalli di trattamento fino a quattro mesi, con mantenimento fino a 72 settimane dei miglioramenti nella visione e riduzione del fluido retinico ottenuti nelle prime 24 settimane.
Attualmente Faricimab è già approvato in più di 90 Paesi per il trattamento della DMLE umida e dell’edema maculare diabetico (DME). L’utilizzo in pazienti con RVO è stato autorizzato nell’ottobre del 2023 dalla Food and Drug Administration degli Stati Uniti, e ora i nuovi dati provenienti dagli studi Balaton e Comino verranno presentati alle altre agenzie regolatorie, compresa l’europea EMA.
Leggi anche:
- Malattia di Stargardt: nuove speranze per i pazienti – Oculista Italiano
- Intelligenza artificiale e OCT nell’edema maculare diabetico – Oculista Italiano
- Nuovi biomarcatori nella retinopatia diabetica (oculistaitaliano.it)
- Cugati S, Wang JJ, Rochtchina E, et al. Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study. Arch Ophthalmol. 2006;124(5):726-32.
- Romano F, Lamanna F, Gabrielle PH, Teo KYC, Battaglia Parodi M, Iacono P, Fraser-Bell S, Cornish EE, Nassisi M, Viola F, Agarwal A, Samanta A, Chhablani J, Staurenghi G, Invernizzi A. Update on Retinal Vein Occlusion. Asia Pac J Ophthalmol (Phila). 2023 Mar-Apr 01;12(2):196-210. doi: 10.1097/APO.0000000000000598. Epub 2023 Feb 14. PMID: 36912792.
- Song P, Xu Y, Zha M, Zhang Y, Rudan I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. J Glob Health. 2019;9(1): 010427.
