El uso creciente de fármacos antiglaucomatosos activos sobre las vías uveoesclerales (principalmente prostaglandinas y prostanoides) ha renovado en los últimos años el interés por el estudio fisiopatológico de estas vías de salida.
Como es bien sabido, la mayor parte del humor acuoso producido se drena por una vía dependiente de la presión, a nivel de la trabécula; se estima que alrededor de 70-80 % del líquido intraocular se elimina, en condiciones fisiológicas, por esta vía. Los 20-30% restantes siguen una vía alternativa, independiente de la presión, y llegan a la supracoroides tras atravesar la matriz extracelular del cuerpo ciliar. Una vez en el espacio supracoroideo, una parte (importante) del humor acuoso reingresa en la circulación mediante reabsorción por la coriocapilar a través de gradientes de presión coloide-osmótica. Sin embargo, una parte no despreciable del líquido consigue atravesar la esclerótica y salir del globo ocular a través de los espacios perineurales y perivasculares de la epiesclerótica y, por tanto, de los tejidos grasos extraorbitarios.2. Por lo tanto, el espacio supracoroideo ocupa una posición intermedia en esta vía, ya que, en última instancia, el humor acuoso fluye a través del músculo ciliar y luego impregna la esclerótica desde la supracoroides. En la mayoría de las estructuras corporales, los fluidos intratisulares extravasculares se reabsorben a través del sistema vascular linfático; la ausencia de una red capilar de este tipo explica que en la esclerótica se activen vías de drenaje alternativas.
Estudios recientes
3 realizados en ojos de ratón han verificado experimentalmente estos hallazgos estudiando las vías acuosas mediante la introducción intracameral de trazadores fluorescentes (dextrano 70-KDa): a partir de los 60' tras la infusión se aprecian claramente signos de filtración transescleral. De lo anterior se desprende que la esclera posee, en última instancia, una conductividad hidráulica propia (entendida como la capacidad de dejar pasar fluidos a través de ella), fundamental para garantizar la realización del flujo de salida transescleral y clínicamente relevante por las implicaciones que puede tener en la regulación de la PIO (presión intraocular) y en los procesos de absorción y eliminación de fármacos. En referencia a este último aspecto, es fácil comprender cómo la existencia de un flujo de fluido dirigido desde el interior hacia el exterior que atraviesa la esclerótica, puede dificultar la absorción de fármacos instilados localmente, o a través de iontoforesis, bombas osmóticas e inyecciones perioculares
4,5. Por otra parte, este fenómeno parece favorecer la eliminación de fármacos dentro del globo ocular. La conductividad hidráulica escleral está influenciada por diversos parámetros, siendo los más importantes la edad y el grosor del tejido: generalmente se observa una relación de proporcionalidad inversa con la primera y directa con el segundo, de forma que cuanto más joven y gruesa es la esclera, menor resistencia ofrece al paso del agua. Esto se debe a que una esclerótica gruesa tendrá mayores espacios entre las láminas de colágeno, mayor hidratación y, por tanto, un menor índice de resistividad hidráulica. Estos aspectos concuerdan con las observaciones existentes en la literatura, que demuestran que el flujo uveoescleral es mayor en los jóvenes, que los niveles de hidratación son más elevados en los donantes jóvenes y que la esclerótica es más complaciente en las cirugías realizadas en ojos de niños. Sin embargo, inesperadamente, la conductividad hidráulica no varía topográficamente, como cabría esperar como consecuencia del diferente grosor escleral entre la porción anterior, ecuatorial y posterior
6Sobre esta base teórica, es fácil ver cómo un conocimiento y un análisis precisos de la capacidad hidroconductora de la esclerótica pueden aportar nuevos enfoques para gestionar la presión intraocular en pacientes con hipertensión ocular o glaucoma.
Importancia del flujo transescleral en la hipertensión ocular y el glaucoma
¿Qué ocurre con el flujo de salida transescleral en pacientes con hipertensión ocular (HO) o glaucoma primario de ángulo abierto (GPAA)? En los últimos años, se ha puesto de manifiesto que es posible estudiar la filtración acuosa transescleral in vivo, analizando las características microscópicas de los flujos filtrantes en pacientes sometidos a cirugía perforante.7,8mediante microscopía confocal de la conjuntiva. En los borradores funcionantes (clínicamente de aspecto difuso o quístico), la presencia de percolación y por tanto flujo acuoso permeando primero la esclerótica y posteriormente las capas conjuntivales, se evidencia por el hallazgo de estructuras microquísticas intraepiteliales (Fig. 1).
[caption id="attachment_1892" align="alignleft" width="150"]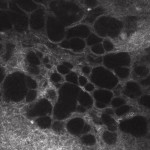 Ph 1: Calado conjuntival funcional: evidencia de numerosos microquistes epiteliales, parcialmente confluentes[/caption].
Ph 1: Calado conjuntival funcional: evidencia de numerosos microquistes epiteliales, parcialmente confluentes[/caption].
En cambio, en las corrientes de aire no funcionales (clínicamente encapsuladas o planas), se observan pocos o ningún microquiste, lo que atestigua el obstáculo mecánico a la percolación que supone la fibrosis subconjuntival. Tales estructuras quísticas representan en última instancia un signo in vivo del paso de líquido transescleral. Recientemente, sin embargo, al estudiar la conjuntiva de pacientes hipertensos oculares y glaucomatosos candidatos a cirugía, se constató la presencia de las mismas estructuras microquísticas descritas en los borradores de trabajo, aunque con una morfología ligeramente diferente. El objetivo del estudio9 era evaluar y describir in vivo, mediante microscopía confocal, la existencia y las características del flujo de salida transescleral en pacientes hipertensos oculares no tratados y en pacientes glaucomatosos sometidos a tratamiento médico.
Características y resultados del estudio
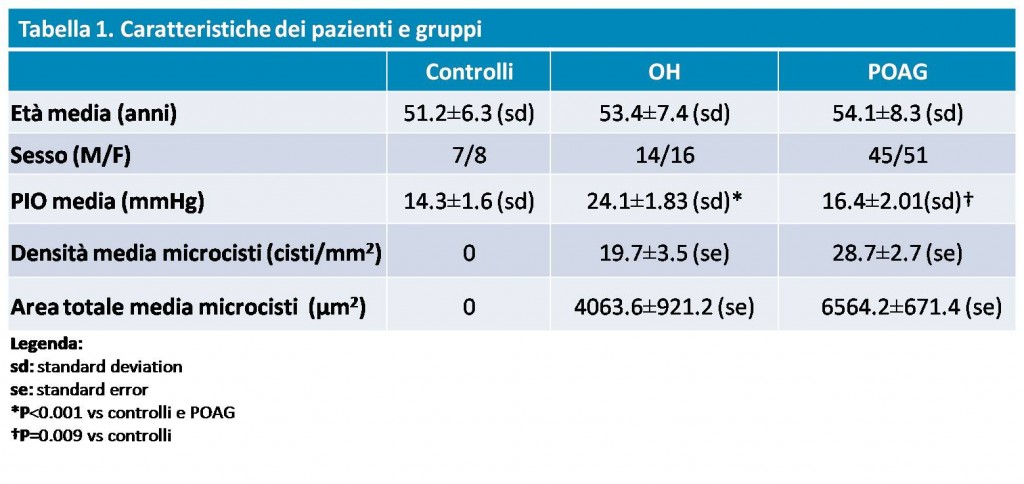
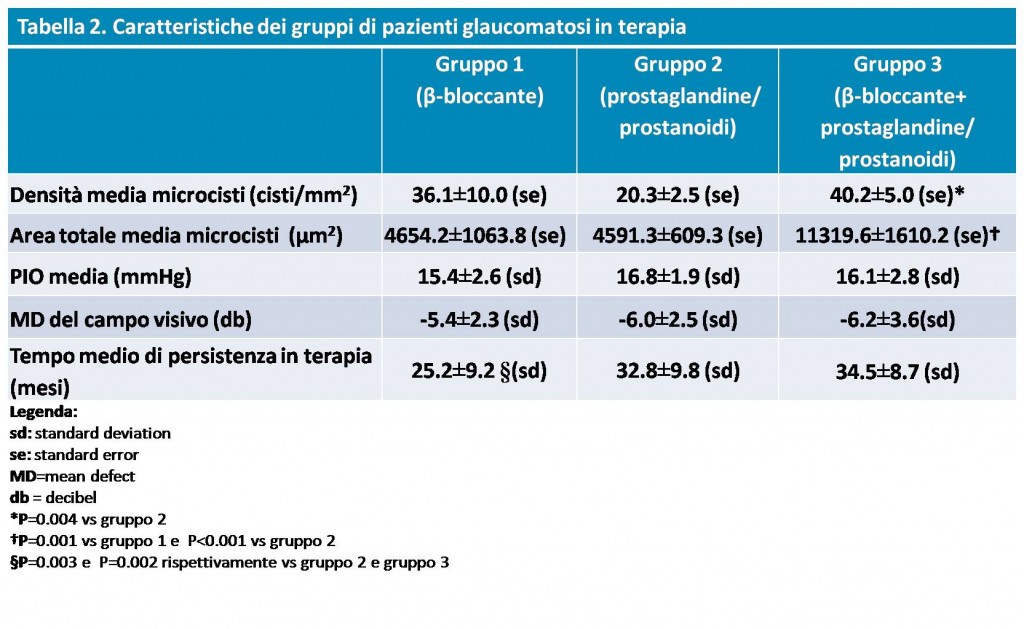
Se incluyeron en el estudio 30 ojos con OH sin tratamiento farmacológico (PIO: 24,1± 1,83 mmHg) y 96 ojos con GPAA en compensación farmacológica (PIO: 16,4±2,01 mmHg) (28 tomaban ?-bloqueantes como monoterapia, Grupo 1; 46 prostaglandinas/prostamidas como monoterapia, Grupo 2; 22 seguían un tratamiento combinado no fijo de prostaglandinas/prostamidas + ? -bloqueantes, Grupo 3); se utilizó como control un grupo de 15 ojos sanos consecutivos (PIO: 14,3±1,6 mmHg). En todos los pacientes se examinó la conjuntiva bulbar superior y temporal mediante microscopía confocal in vivo (LSM; HRT II Cornea Module; Heidelberg Engineering GmbH, Heidelberg, Alemania).
[caption id="attachment_1893" align="alignleft" width="150"]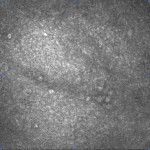 Ph 2: Ojo de control: no se aprecian microquistes en el epitelio conjuntival[/caption].
Ph 2: Ojo de control: no se aprecian microquistes en el epitelio conjuntival[/caption].
Se consideraron dos parámetros: la densidad media (quistes/mm2) y la superficie total de los microquistes (µm2), calculada esta última mediante ImageJ, un programa informático de código abierto disponible en línea (http://rsb.info.nih. gov/ij/).
Los resultados obtenidos y las características de los grupos figuran en el cuadro 1.
Como se desprende de los datos, las estructuras microquísticas están ausentes en los ojos normales (Fig. 2), mientras que son apreciables en todos los ojos hipertensos (Fig. 3) y glaucomatosos (Fig. 4), sin diferencias significativas entre OH y POAG.
Sin embargo, se observaron diferencias significativas entre los 3 subgrupos de pacientes glaucomatosos sometidos a tratamiento, con valores medios de densidad microquística más elevados en el Grupo 3 que en el Grupo 2 y valores medios de área total más elevados en el Grupo 3 que en el Grupo 1.
Conclusiones
De los resultados obtenidos pueden extraerse algunas conclusiones importantes, que en varios aspectos constituyen nuevos conceptos en la fisiopatología de la hidrodinámica ocular y la enfermedad glaucomatosa. De hecho, la presencia de microquistes conjuntivales intraepiteliales en ojos con hipertensión ocular no tratada es un signo claro de la activación de vías de salida alternativas en condiciones hiperbáricas: en presencia de una PIO elevada y una probable saturación de las vías de salida trabeculares canónicas, el humor acuoso intenta en última instancia abandonar el globo ocular por vías transesclerales, permeando sucesivamente la esclerótica y la conjuntiva. Lo mismo ocurre, sin diferencias sustanciales, en los pacientes glaucomatosos sometidos a tratamiento, lo que atestigua que el flujo transescleral se activa en una fase muy temprana del proceso.
Analizando el factor presión ocular, dada la ausencia de correlación significativa entre la PIO y la densidad-área de microquistes tanto en pacientes con OH como con GPAA, parece que el elemento PIO elevada constituye un momento fundamental en la activación del proceso, aunque no sea su único determinante. De hecho, esta hipótesis podría verse confirmada por la evidencia de que la presión intraocular no parece ser necesaria en el impulso para mantener la filtración, dada la persistencia del flujo de salida transescleral a pesar del control farmacológico de la PIO en pacientes glaucomatosos.
Sobre la base de las consideraciones iniciales y a la luz de los resultados obtenidos en el presente estudio, podemos hipotetizar en última instancia que en condiciones hiperbáricas se activan mecanismos de compensación hidrodinámica que explotan la conductividad hidráulica escleral, en virtud de los cuales el sistema cerrado del globo ocular trataría de reducir las fuerzas de tensión internas (dependientes de la PIO) mediante la descarga de humor acuoso más allá de la conjuntiva. Además, ciertamente no se trata de artefactos debidos a los principios activos o conservantes de los fármacos antiglaucomatosos, dada la presencia de estructuras microquísticas incluso en hipertensos oculares no sometidos a terapia. No obstante, las diferencias entre los subgrupos de pacientes glaucomatosos en tratamiento farmacológico son difíciles de explicar con los datos adquiridos hasta el momento y deben verificarse con estudios posteriores. En conclusión, las vías de salida transesclerales, demostradas ahora también in vivo, se revelan fundamentales y primarias en los mecanismos de compensación a los que puede recurrir el ojo en condiciones hiperbáricas, en las que se reduce el flujo de salida trabecular. La primera consecuencia es que la conjuntiva, finalmente definible como terminal de esta vía, constituye una nueva estructura diana, fácilmente accesible para el diagnóstico, donde pueden investigarse y estudiarse los cambios inducidos por la enfermedad glaucomatosa. Analizarlo en términos terapéuticos, disponiendo en un futuro próximo de fármacos capaces de explotar y aumentar esta vía de salida, podría sin duda permitir una gestión mejor y más eficaz de la PIO.
Leonardo Mastropasqua,
Marco Ciancaglini,
Luca Agnifili
Clínica Oftalmológica - Centro de Excelencia en Oftalmología Universidad G. d'Annunzio Chieti-Pescara
Bibliografía
1. Weinreb RN, Toris CB, Gabelt BT, et al. Efectos de las prostaglandinas en las vías de salida del humor acuoso. Surv Ophthalmol. 2002; 47(suppl 1):S53-S64.
2. Inomata H, Bill A. Exit sites of uveoscleral flow of aqueous humor in cynomolgus monkey eyes. Exp Eye Res. 1977;25:113-118.
3. Lindsey JD, Weinreb RN. Identification of the Mouse Uveoscleral Outflow Pathway Using Fluorescent Dextran. Invest Ophthalmol Vis Sci. 2002;43:2201-2205.
4. Myles ME, Neumann DM, Hill JM. Recent progress in ocular drug delivery for posterior segment disease: emphasis on transscleral iontophoresis. Adv Drug Deliv Rev. 2005;57:2063-2079.
5. Ambati J, Gragoudas ES, Miller JW, et al. Transscleral delivery of bioactive protein to the choroid and retina. Invest Ophthalmol Vis Sci. 2000;41:1186-1191.
6. Olsen TW, Aaberg SY, Geroski DH, Edelhauser HF. Human sclera: thickness and surface area. Am J Ophthalmol. 1998;125:237-241.
7. Labbé A, Dupas B, Hamard P, Baudouin C. Estudio por microscopía confocal in vivo de las vesículas después de la cirugía filtrante. Ophthalmology 2005; 112:1979.
8. Ciancaglini M, Carpineto P, Agnifili L, Nubile M, Lanzini M, Fasanella V, Mastropasqua L. Filtering Bleb Functionality: a Clinical, Anterior Segment Optical Coherence Tomography and In Vivo Confocal Microscopy Study. J Glaucoma. 2008. Jun-Jul;17(4):308-17.
9. Ciancaglini M, Carpineto P, Agnifili L, Nubile M, Fasanella V, Mastropasqua L. Conjunctival modifications in ocular hypertension and primary open angle glaucoma: an in vivo confocal microscopy study. Invest Ophthalmol Vis Sci. 2008. Jul;49(7):3042-8. Epub 2008 Mar 3.
Dr. Carmelo Chines
Director responsable




