Entrevistamos al Dr. Florian Sennlaub, Director del Equipo 14: "Inflamación, degeneración y remodelación vascular" del Instituto de la Visión de París, sobre las últimas novedades en inflamación y DMAE.
¿Existen, por tanto, nuevas dianas hacia las que dirigir la investigación farmacológica?
Estudios recientes sugieren que los mediadores de la inflamación desempeñan un papel importante en la fisiopatología de la DMAE. Se ha demostrado que las drusas (depósitos subretinianos blanquecinos) contienen moléculas del sistema inmunitario como complejos inmunitarios, factores del complemento, complejo mayor de histocompatibilidad (MAHC) y oligómeros amiloides. Por otra parte, la DMAE está asociada a un polimorfismo que atenúa la función del factor H y, con la pérdida de la actividad inhibidora del factor H, el sistema del complemento se vuelve hiperactivo durante la DMAE. Sin embargo, sigue sin estar claro cómo contribuye la hiperactivación del complemento a la patogénesis de la DMAE.
Las células microgliales, macrófagos residentes en el sistema nervioso central, se localizan en la retina interna [1] y normalmente están ausentes de la capa fotorreceptora y del espacio subretiniano situado entre el epitelio pigmentario de la retina (EPR) y la retina. En la DMAE, los macrófagos se activan y se acumulan [2, 3] en el espacio subretiniano [1, 4]. Esta acumulación se ha interpretado como un efecto secundario. Los macrófagos serían reclutados para limpiar la capa fotorreceptora de células muertas.
[caption id="attachment_759" align="aligncenter" width="267" class=" "]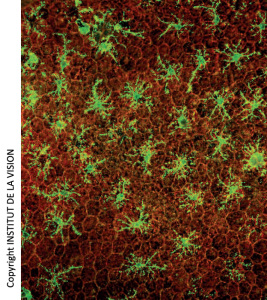 Macrófagos subretinianos en montajes horizontales del epitelio pigmentado de la retina (EPR). En rojo, las células del EPR (panal). En verde, los macrófagos[/caption].
Macrófagos subretinianos en montajes horizontales del epitelio pigmentado de la retina (EPR). En rojo, las células del EPR (panal). En verde, los macrófagos[/caption].
En la última década, numerosos estudios han abordado el papel de las quimiocinas, pequeñas proteínas secretadas que reclutan macrófagos en las enfermedades inflamatorias. Las quimiocinas CCL2 y CX3CL1 desempeñan un papel clave en el reclutamiento y la activación de monocitos, macrófagos y células microgliales [5, 6].
La quimiocina CCL2 se libera a través de la lesión tisular y participa en el reclutamiento de monocitos inflamatorios circulantes que sobreexpresan el receptor CCR2. Los monocitos inflamatorios reclutados reducen rápidamente la expresión de CCR2 y se diferencian en macrófagos inflamatorios (M?). Los macrófagos inflamatorios (M?) secretan una serie de factores bactericidas que también pueden tener un efecto neurotóxico. Posteriormente, los M? adquieren un fenotipo menos agresivo que favorece la angiogénesis y la cicatrización, antes de desaparecer o permanecer en el tejido durante mucho tiempo como macrófago tisular.
CX3CL1 es una quimioquina atípica: es una proteína transmembrana con una función similar a la integrina. En el ojo, se expresa de forma constitutiva en las neuronas de la retina y del EPR. Su receptor, CX3CR1, se expresa en grandes cantidades en las células microgliales [1, 7].
La señalización CX3CL1/CX3CR1 induce un fenotipo de apoyo en las células microgliales (MC). CX3CL1, escindido de la membrana por proteasas a una forma soluble, puede desarrollar propiedades quimiotácticas [8].
Un macrófago completamente diferenciado pero derivado de un monocito infiltrante puede llegar a ser muy similar a una célula microglial, presente en la retina tras el desarrollo fetal, tanto en términos de su morfología como de las proteínas que expresa.
¿Tienen estos estudios alguna relación con la patogénesis de la DMAE?
Hace unos años observamos con gran sorpresa que los ratones que carecen del gen Cx3cr1 (ratones Cx3cr1-/) presentan una acumulación espontánea dependiente de la edad de células inflamatorias (M? o MCs) en el espacio subretiniano. Esta acumulación se produce en ausencia de degeneración inicial de fotorreceptores o EPR [1]. Los resultados contrastan fuertemente con el comportamiento de las M? en el tejido inflamatorio periférico, que muestra un déficit de acumulación en las zonas de lesión tras la ausencia de Cx3cr1 [6].
[caption id="attachment_760" align="aligncenter" width="143" class=" "]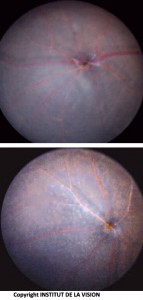 Parte inferior del ojo de ratones knockout y control. Los macrófagos subretinianos (ratón knockout) son visibles como pequeños puntos blancos[/caption].
Parte inferior del ojo de ratones knockout y control. Los macrófagos subretinianos (ratón knockout) son visibles como pequeños puntos blancos[/caption].
En los ratones Cx3cr1-/-, la presencia prolongada de MMC en el espacio subretiniano se asocia a una fagocitosis excesiva de los segmentos externos de los fotorreceptores por parte de los MMC, lo que provoca la acumulación de lípidos intracelulares [9, 1].
¿Cuáles son, en resumen, los objetivos y los posibles desarrollos terapéuticos de las actividades llevadas a cabo por su grupo de investigación?
Las investigaciones llevadas a cabo en nuestro laboratorio tratan de identificar los mecanismos de reclutamiento de macrófagos en el espacio subretiniano, los factores que favorecen su supervivencia y, por tanto, su acumulación, y los factores neurotóxicos y angiogénicos secretados por las células inflamatorias.
Este concepto innovador nos permitirá desarrollar nuevas terapias farmacológicas destinadas a prevenir la acumulación de macrófagos y/o sus factores patógenos. En animales, estos tratamientos son capaces de prevenir tanto la degeneración de los fotorreceptores como la neovascularización. En humanos, podrían constituir un nuevo tratamiento terapéutico para las formas atrófica y húmeda de la DMAE en un futuro relativamente próximo.
Bibliografía
1) Combadiere C, Feumi C, Raoul W, Keller N, Rodero M, Pezard A, Lavalette S, Houssier M, Jonet L, Picard E, Debre P, Sirinyan M, Deterre P, Ferroukhi T, Cohen SY, Chauvaud D, Jeanny JC, Chemtob S, Behar-Cohen F, Sennlaub F (2007) CX3CR1-dependent subretinal microglia cell accumulation is associated with cardinal features of age-related macular degeneration. J Clin Invest 117:2920-2928.
2) Penfold PL, Liew SC, Madigan MC, Provis JM (1997) Modulation of major histocompatibility complex class II expression in retinas with age-related macular degeneration. Invest Ophthalmol Vis Sci 38:2125-2133.
3) van der Schaft TL, Mooy CM, de Bruijn WC, de Jong PT (1993) Early stages of age-related macular degeneration: an immunofluorescence and electron microscopy study. Br J Ophthalmol 77:657-661.
4) Gupta N, Brown KE, Milam AH (2003) Activated microglia in human retinitis pigmentosa, late-onset retinal degeneration, and age-related macular degeneration. Exp Eye Res 76:463-471.
5) Combadiere C, Potteaux S, Rodero M, Simon T, Pezard A, Esposito B, Merval R, Proudfoot A, Tedgui A, Mallat Z (2008) Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6C(hi) and Ly6C(lo) monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice. Circulation 117:1649-1657.
6) Combadiere C, Potteaux S, Gao JL, Esposito B, Casanova S, Lee EJ, Debre P, Tedgui A, Murphy PM, Mallat Z (2003) Decreased atherosclerotic lesion formation in CX3CR1/apolipoprotein E double knockout mice. Circulation 107:1009-1016.
7) Checchin D, Sennlaub F, Levavasseur E, Leduc M, Chemtob S (2006) Potential role of microglia in retinal blood vessel formation. Invest Ophthalmol Vis Sci 47:3595-3602.
8) Ransohoff RM (2009) Chemokines and chemokine receptors: standing at the crossroads of immunobiology and neurobiology. Immunity 31:711-721.
9) Raoul W, Feumi C, Keller N, Lavalette S, Houssier M, Behar-Cohen F, Combadiere C, Sennlaub F (2008) Lipid-bloated subretinal microglial cells are at the origin of drusen appearance in CX3CR1-deficient mice. Ophthalmic Res 40:115-119.
10) Zweifel SA, Imamura Y, Spaide TC, Fujiwara T, Spaide RF (2010) Prevalence and Significance of Subretinal Drusenoid Deposits (Reticular Pseudodrusen) in Age-Related Macular Degeneration. Ophthalmology.
11) Rudolf M, Malek G, Messinger JD, Clark ME, Wang L, Curcio CA (2008) Sub-retinal drusenoid deposits in human retina: organisation and composition. Exp Eye Res 87:402-408.
12) Cohen SY, Dubois L, Tadayoni R, Delahaye-Mazza C, Debibie C, Quentel G (2007) Prevalence of reticular pseudodrusen in age-related macular degeneration with newly diagnosed choroidal neovascularisation. Br J Ophthalmol 91:354-359.
13) Raoul W, Keller N, Rodero M, Behar-Cohen F, Sennlaub F, Combadiere C (2008) Role of the chemokine receptor CX3CR1 in the mobilisation of phagocytic retinal microglial cells. J Neuroimmunol 198:56-61.
14) Ma W, Zhao L, Fontainhas AM, Fariss RN, Wong WT (2009) Microglia in the mouse retina alter the structure and function of retinal pigmented epithelial cells: a potential cellular interaction relevant to AMD. PLoS One 4:e7945.
15) Roque RS, Rosales AA, Jingjing L, Agarwal N, Al-Ubaidi MR (1999) Retina-derived microglial cells induce photoreceptor cell death in vitro. Brain Res 836:110-119.
16) Nakazawa T, Hisatomi T, Nakazawa C, Noda K, Maruyama K, She H, Matsubara A, Miyahara S, Nakao S, Yin Y, Benowitz L, Hafezi-Moghadam A, Miller JW (2007) Monocyte chemoattractant protein 1 mediates retinal detachment-induced photoreceptor apoptosis. Proc Natl Acad Sci U S A 104:2425-2430.
Para más información, póngase en contacto con
Florian Sennlaub
Instituto de la Visión
17, rue Moreau
75012 París - Francia
E.mail: Florian.sennlaub[at]inserm.fr
Página web: www.institut-vision.org
Dr. Carmelo Chines
Director responsable


