La la miopía es una de las principales causas de discapacidad visual en el mundo. En las dos últimas décadas, esta enfermedad ha tenido una prevalencia casi pandémica, registrándose alrededor de 1.406 millones de casos (22,9% de la población mundial) en 2000, de los cuales 2,7% tenían un alto grado de miopía (-6,00 dioptrías o peor). Se prevé que el La prevalencia mundial de la miopía aumentará a 49,8% en 2050.
A pesar de la posibilidad de corrección, la miopía sigue siendo una patología preocupante, ya que representa el factor de riesgo dominante de determinadas enfermedades oculares como la maculopatía miópica, el desprendimiento de retina, el glaucoma y las cataratas. Para cada una de estas afecciones, el el riesgo aumenta a medida que aumenta el grado de miopía. Por lo tanto, existe una necesidad urgente de definir la patogénesis que subyace a la aparición de la enfermedad y de desarrollar intervenciones terapéuticas eficaces y seguras para la prevención de las complicaciones asociadas.
La miopía está causada por un alargamiento axial excesivo del ojo que hace que la retina se sitúe por detrás del plano focal, este cambio va acompañado de la Adelgazamiento de la esclerótica, mantener la forma y la integridad oculares. Diversos estudios han investigado los mecanismos subyacentes al adelgazamiento y debilitamiento de la esclerótica relacionados con la miopía, entre ellos algunos han demostrado un papel de la remodelación de la matriz extracelular (MEC) escleral relacionados con la síntesis desacelerada y la degradación acelerada de los componentes de la MEC. Por ejemplo, durante la aparición de la miopía, la renovación del colágeno de tipo I (principal componente de la EMC escleral) aumenta debido a una regulación a la baja de su síntesis y a un aumento de su degradación, lo que conduce a un cambio en la MEC escleral. A pesar de estos conocimientos y de numerosos modelos experimentales, aún se desconocen las señales fisiológicas que desencadenan estos cambios. Algunos estudios genéticos y farmacológicos han planteado la hipótesis de la implicación de varias señales moleculares en el desarrollo de la miopía, como el ácido retinoico, la acetilcolina, la dopamina retiniana, la señalización mediada por el receptor escleral TGF-? y los receptores A2A para la adenosina. En todos los casos se desconoce la naturaleza de los mediadores de la comunicación entre retina y esclerótica. El análisis molecular de los mecanismos subyacentes a la remodelación escleral no es sencillo, de hecho, no existe ningún método para tratar la heterogeneidad celular de los tejidos escleróticos. La esclerótica de los mamíferos está compuesta por una única capa fibrosa de tejido conjuntivo que contiene fibroblastos y miofibroblastos. Los primeros secretan colágeno de tipo I, que es el principal componente de las fibras de colágeno y otros componentes de la MEC, mientras que los miofibroblastos son células contráctiles derivadas de la transdiferenciación gradual de los fibroblastos. Aislar y analizar cada uno de estos diferentes tipos de células escleróticas, con el fin de identificar los posibles mediadores de señales que activan la remodelación escleral de la MEC y el desarrollo de la miopía, es experimentalmente difícil.
En este estudio, los autores utilizaron el secuenciación de ARN unicelular (scRNA-seq) para identificar los distintos perfiles de expresión de las poblaciones celulares de la esclerótica con el fin de arrojar luz sobre los cambios fenotípicos celulares (es decir, la transdiferenciación fibroblasto/miofibroblasto) y las alteraciones de la MEC durante la patogénesis de la miopía.
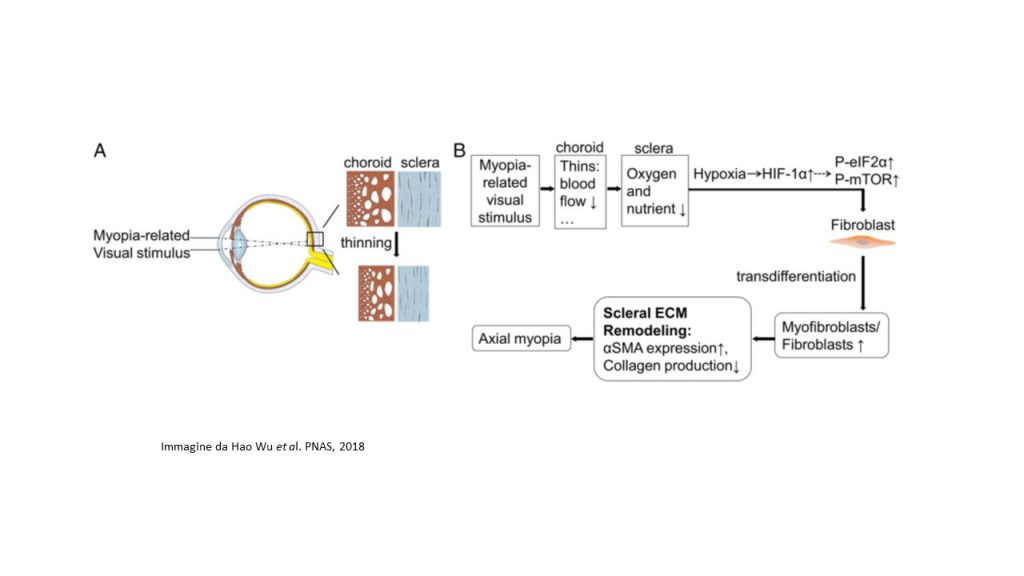 El estudio publicado recientemente en PNAS, señaló que, en el esclerótica miópica de los modelos de ratón, el señales de hipoxia, a saber, las vías eIF2 (Factor de iniciación eucariota 2) y mTOR (diana mamífera de la rapamicina), se activaron. Los autores, con múltiples líneas de evidencia experimental establecen que la hipoxia escleral es un factor crítico que contribuye al desarrollo de la miopía. En primer lugar, el análisis scRNA-seq reveló que el desarrollo de la miopía se asocia con la transdiferenciación de fibroblastos en miofibroblastos, cuyas principales diferencias funcionales surgen de la activación de vías relacionadas con la hipoxia (vías de señalización eIF2 y mTOR). Muchos genes implicados en vía de señalización del factor inducible por hipoxia HIF-1? (Factor 1-alfa inducible por hipoxia), asociados a genes de riesgo implicados en la miopía humana o patológica.
El estudio publicado recientemente en PNAS, señaló que, en el esclerótica miópica de los modelos de ratón, el señales de hipoxia, a saber, las vías eIF2 (Factor de iniciación eucariota 2) y mTOR (diana mamífera de la rapamicina), se activaron. Los autores, con múltiples líneas de evidencia experimental establecen que la hipoxia escleral es un factor crítico que contribuye al desarrollo de la miopía. En primer lugar, el análisis scRNA-seq reveló que el desarrollo de la miopía se asocia con la transdiferenciación de fibroblastos en miofibroblastos, cuyas principales diferencias funcionales surgen de la activación de vías relacionadas con la hipoxia (vías de señalización eIF2 y mTOR). Muchos genes implicados en vía de señalización del factor inducible por hipoxia HIF-1? (Factor 1-alfa inducible por hipoxia), asociados a genes de riesgo implicados en la miopía humana o patológica.
El equipo de investigación también señaló que exposición a la hipoxia (5% O2) promovió la transdiferenciación de miofibroblastos con una regulación a la baja del colágeno de tipo I en los fibroblastos esclerales humanos. Otro hallazgo importante del estudio es que, en cobayas, el uso de compuestos contra la hipoxia, como el salidrosido y la formononetina, redujeron la regulación de HIF-1?, así como los niveles de fosforilación de eIF2? y mTOR, frenando así la progresión de la miopía experimental, sin alterar el crecimiento ocular normal. Además, la inhibición de la fosforilación de eIF2? suprimió la miopía inducida experimentalmente, mientras que la fosforilación de la miopía inducida por mTOR en modelos de ratones sanos.
En conjunto, los resultados de este estudio definieron un papel esencial de la hipoxia en la remodelación de la MEC escleral y el desarrollo de la miopía. La identificación de la hipoxia escleral en la miopía contribuye no sólo a la comprensión de los mecanismos de desarrollo de la miopía, sino que también sugiere un enfoque terapéutico viable para controlar la progresión de la miopía en los seres humanos.
Fuente
La hipoxia escleral es un objetivo para el control de la miopía. Hao Wu y al. Actas de la Academia Nacional de Ciencias (PNAS). Jul 2018.
Dr. Carmelo Chines
Director responsable
