Nuevas revisiones surgen de la monografía de varios autores también sobre la
aspectos inflamatorios relacionados con la cirugía ocular e
en el restablecimiento de la función de los tejidos. En el lugar de la lesión, las células liberan señales moleculares que provocan una serie de cambios en la zona afectada: dilatación de los vasos sanguíneos, aumento del flujo sanguíneo y de la permeabilidad vascular, exudación de fluidos que contienen proteínas como inmunoglobulinas e invasión por leucocitos. En el proceso inflamatorio intervienen distintos tipos de leucocitos, como granulocitos, monocitos y linfocitos.
Los continuos avances en el conocimiento de las vías bioquímicas y celulares asociadas a la respuesta inflamatoria han permitido adentrarse en los mecanismos más recónditos de las patologías oculares. El clínico tiene así la posibilidad de utilizar no sólo fármacos ya probados y consolidados clínicamente (corticosteroides, antiinflamatorios no esteroideos, antiproliferativos, antisupresores, biofármacos), sino también de probar nuevas hipótesis farmacológicas para algunas patologías oculares más complejas gracias a las cuales, también con el apoyo de nuevos métodos de administración de fármacos, hoy es posible tratar con suficiente eficacia muchos procesos inflamatorios oculares del segmento anterior (por ejemplo, ojo seco, queratitis, conjuntivitis) y también del segmento ocular del ojo. ojo seco, queratitis, conjuntivitis) y también del segmento posterior del ojo (por ejemplo, edema macular diabético, uveítis). Sin embargo, aunque se dispone de un amplio arsenal terapéutico, para algunas afecciones patológicas oculares, especialmente las caracterizadas por una elevada cronicidad, el uso de determinados fármacos plantea problemas de eficacia y/o toxicidad. La inflamación crónica y prolongada es un rasgo definitorio de enfermedades como la aterosclerosis, la obesidad, la diabetes, la artritis reumatoide, el asma y diversos tipos de cáncer. Muchas de estas enfermedades tienen ahora manifestaciones oculares establecidas en la retinopatía diabética, la escleritis, la uveítis, el síndrome del ojo seco y las neoplasias oculares. Esto también nos lleva a observar con detenimiento los avances farmacológicos y clínicos que se están produciendo en ámbitos aparentemente alejados de la aplicación oftálmica, pero que potencialmente, por traslación, también podrían ser utilizables en el campo ocular. En efecto, a pesar de que muchos tejidos oculares disponen de un sistema inmunoprivilegiado o muy evolucionado para proteger el delicado eje visual1-3 el control esencial de la inflamación aguda está regulado por las mismas vías generales, mediadores y células efectoras que gestionan las respuestas inflamatorias en otros órganos. No es casualidad que la mayoría de los inmunosupresores utilizados en las enfermedades oculares inflamatorias se desarrollaran originalmente en la medicina de trasplantes, para las enfermedades reumáticas u otras enfermedades sistémicas de origen inflamatorio.
Recientemente, se ha observado una alteración significativa en el perfil de citoquinas y quimioquinas en muestras de humor acuoso de pacientes diabéticos sin patología retiniana manifiesta, pero con una marcada similitud a lo encontrado en pacientes con retinopatía manifiesta4. Esta información científica no sólo respalda el hecho de que la inflamación crónica desempeña un papel importante en la patogénesis de la retinopatía, sino que también sugiere que el proceso inflamatorio se activa incluso antes de que se diagnostique clínicamente la retinopatía (diabética y/o proliferativa). La alteración en el perfil de ciertas citoquinas podría, por tanto, convertirse tanto en un marcador predictivo, como en una diana importante para el desarrollo de futuras opciones terapéuticas. Además, las consideraciones descritas hasta ahora refuerzan la hipótesis de que, aunque el armamentario terapéutico actual permite el manejo eficaz del componente inflamatorio de muchas patologías oculares, la demanda por parte de los pacientes de nuevas pruebas diagnósticas, nuevos fármacos más eficaces y/o más seguros aún tiene amplios márgenes experimentales que satisfacer. En el resto de este artículo, se retomarán algunas pinceladas sobre la farmacología de la inflamación para señalar algunos ejemplos del desarrollo de potenciales nuevos enfoques terapéuticos que podrían, en un futuro próximo, resultar alternativos y/o complementarios a los actualmente en uso.
Experimentación farmacológica y aplicación clínica
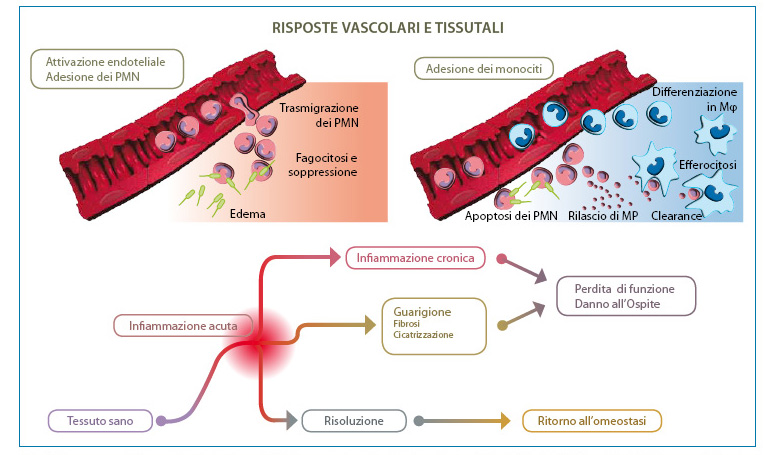
Una característica distintiva de la mayoría de las respuestas inflamatorias es el reclutamiento de polimorfonucleados (PMN) en el endotelio vascular activado. Una excepción son las respuestas autoinmunes o alérgicas impulsadas por linfocitos, aunque los linfocitos o macrófagos también inician respuestas inflamatorias (por ejemplo, asma, artritis reumatoide) caracterizadas por una infiltración pronunciada de PMN o eosinófilos en el tejido dañado. De hecho, la activación excesiva o la desregulación de los PMN puede causar daños considerables al tejido implicado en la inflamación, como se observa en casos de isquemia-reperfusión, fibrosis corneal y queratitis. Y lo que es más importante, el acontecimiento transitorio temprano en la respuesta inflamatoria debido a la infiltración de PMN desencadena el movimiento de macrófagos hacia la eliminación eficaz de los PMN que ya no están activos, un paso clave en la resolución de la inflamación aguda.5 (Fig. 2). Por lo tanto, es evidente lo esencial que resulta comprender los mecanismos de este proceso para la investigación y el desarrollo de nuevos agentes terapéuticos antiinflamatorios.6,7.
Fig. 2. La inflamación útil requiere una resolución activa. Los tejidos experimentan inflamaciones agudas frecuentes en respuesta a lesiones, estrés o infecciones. El reclutamiento de PMN en el lecho vascular se inicia y amplifica mediante circuitos proinflamatorios bien estructurados y organizados. La ejecución satisfactoria de la inflamación aguda requiere la fagocitosis de los PMN por los macrófagos, una respuesta no inflamatoria. La fagocitosis de PMN induce la formación de mediadores antiinflamatorios para restaurar la función normal del tejido. Los circuitos residentes en la córnea, la úvea y la retina, es decir, 15-LOX y/o HO producen autacoides que contrarrestan los circuitos proinflamatorios, reducen la infiltración de PMN y activan a los macrófagos para la eliminación de PMN. La desregulación de este proceso fundamental sienta las bases para el desarrollo de enfermedades inflamatorias. Modificado de: Gronert K. 'Resolution, the grail for healthy ocular inflammation'. Exp. Eye Res. 2010; 91(4):478-85.
La inflamación aguda es un proceso dinámico en evolución y, como tal, también representa un estado "inestable" que puede resolverse o persistir. En general, la inflamación aguda avanza hacia su resultado natural ideal, que es la resolución, con la neutralización de los agentes nocivos, el cese de la infiltración de PMN y la restauración funcional del tejido (Fig. 2). Tradicionalmente, las terapias antiinflamatorias oculares se han centrado en estrategias que disminuyen o neutralizan el nivel de mediadores proinflamatorios y/o inhiben la activación leucocitaria. Estas terapias incluyen antiinflamatorios no esteroideos (AINE), agonistas del receptor de glucocorticoides (GC) e inhibidores de citoquinas proinflamatorias específicos de anticuerpos o dianas, como el factor de necrosis tumoral alfa (TNF)-? y la interleucina (IL)-1. En los últimos años se ha reconocido que la estrategias terapéuticas basadas en la pro son potencialmente eficaces en el tratamiento de múltiples afecciones inflamatorias8-11. En realidad, la resolución es un proceso activo en el que intervienen innumerables mediadores y diferentes vías de control bioquímico, y se lleva a cabo mediante:
1) Resolución de la respuesta inflamatoria;
2) pasar de la generación de mediadores proinflamatorios a la producción de mediadores proresolución; 3) apagar la transducción de señales asociada a la producción de citocinas y a la supervivencia de los leucocitos;
4) Apoptosis de las células inflamatorias activadas;
5) fagocitosis de células apoptóticas (principalmente por macrófagos en un proceso no logístico)
6) cambio de fenotipos celulares proinflamatorios a proresolutivos (especialmente relevante para los macrófagos).
Mediadores pro-lípidos
El descubrimiento de una serie de mediadores lipídicos, derivados de los ácidos grasos poliinsaturados, como agentes antiinflamatorios y proinflamatorios-resolutivos se debe principalmente a Serhan y sus colaboradores12-14. Se trata de lipoxinas, resolvinas de la serie E (RvE) y D (RvD), protectinas/neuroprotectinas y maresinas. Las resolvinas, lipoxinas, protectinas y maresinas se sintetizan a partir del ácido araquidónico (AA) y de los ácidos grasos eicosapentaenoico (EPA) y docosahexaenoico (DHA) (Fig. 3).
[caption id="attachment_1227" align="aligncenter" width="450"]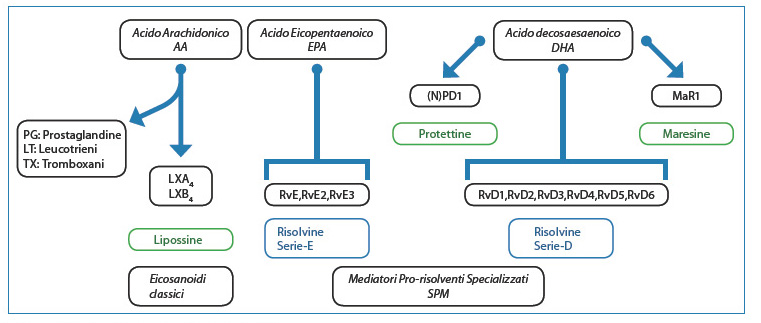 Fig 3. Biosíntesis de mediadores de prolongación lipídica[/caption].
Fig 3. Biosíntesis de mediadores de prolongación lipídica[/caption].
La biosíntesis se produce como eventos transcelulares, cuyos detalles han sido examinados recientemente por Serhan15. El uso de la lipidómica también permitió al grupo de Serhan identificar y caracterizar nuevas familias de mediadores lipídicos (Fig. 4).
[caption id="attachment_1228" align="aligncenter" width="450"]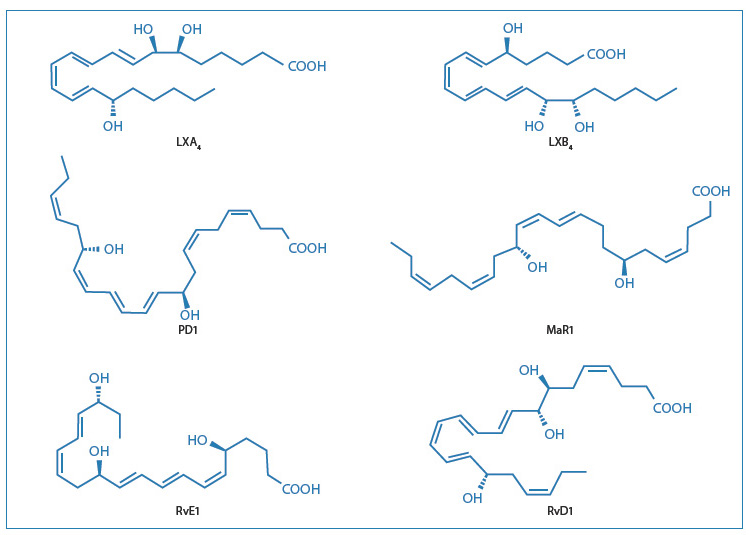 Fig. 4 - Estructuras de los principales mediadores pro lípidos[/caption].
Fig. 4 - Estructuras de los principales mediadores pro lípidos[/caption].
Los mediadores pro-resolución son lípidos bioactivos secretados en respuesta a un estado inflamatorio y que estimulan los acontecimientos moleculares y celulares para su resolución. De hecho, los mediadores lipídicos son capaces de promover una serie de acciones, como el bloqueo de leucotrienos y prostaglandinas, la reducción de la liberación de citocinas y el reclutamiento de monocitos, así como la reducción de la eliminación no flogística de PMN apoptóticos, esencial para la homeostasis tisular. También se ha demostrado que los mediadores lipídicos desempeñan un papel modulador en varios modelos animales experimentales de inflamación aguda y crónica de artritis, peritonitis, isquemia-reperfusión, dolor y asma.16-22. Las terapias que promueven activamente la resolución también pueden tener la ventaja de mejorar las respuestas inmunitarias innatas causadas por las infecciones bacterianas21. La posibilidad de tratar la inflamación sin comprometer las defensas inmunitarias del huésped parece ser la característica más importante que puede lograrse mediante la administración de lipoxinas, resolvinas y protectinas, o incluso mejor sus análogos sintéticos estables, como agentes terapéuticos en el tratamiento de diversas enfermedades inflamatorias oculares. En conjunto, por tanto, los estudios que se mencionarán son interesantes para las perspectivas de desarrollo de nuevos fármacos antiinflamatorios.
En concreto, este nuevo enfoque cambia el uso tradicional de los antiinflamatorios delantagonismo (terapia inhibitoria) a agonismo (terapia proinhibitoria). La ventaja de utilizar fármacos inmunorresolutivos es que limitan la infiltración continua de neutrófilos, contrarrestan los mediadores proinflamatorios, mejoran la contención y la fagocitosis de los restos celulares y los neutrófilos apoptóticos, y favorecen el restablecimiento de la homeostasis tisular.
Lipoxina
Lipoxina A4 (LXA4), lipoxina B4 (LXB4) y la lipoxina activada por aspirina (ATL) fueron de los primeros mediadores biosintetizados por el ácido araquidónico en ser reconocidos como mediadores lipídicos antiinflamatorios y pro-restauradores.23. En particular, LXA4, la lipoxina más estudiada, se une con gran afinidad al receptor FPR2/ALX24,25Se expresa en diferentes tipos de células, incluidos neutrófilos y monocitos, y es un regulador de algunas funciones importantes de la respuesta inmunitaria. Activación de FPR2/ALX por LXA4 reduce los leucotrienos, la migración de leucocitos, la producción de quimiocinas inducida por el factor de necrosis tumoral (TNF), la expresión de receptores de quimiocinas y moléculas de adhesión, la producción de interleucina IL-12 activada por patógenos y la formación de superóxido, mejorando así la fagocitosis no flogística de células apoptóticas por los macrófagos.26-28. Estos resultados también explican por qué el receptor FPR2/ALX es actualmente objeto de una intensa búsqueda farmacológica de nuevos agentes antiinflamatorios.
También se ha demostrado que el circuito lipídico autacoide activado por 15-LOX desempeña un papel clave en la generación de lipoxina A4 y también está presente en la córnea, la retina y la úvea29-35.
En un estudio reciente, se estableció en particular que los sistemas 15-LOX y hemo oxigenasa (HO) trabajan en concierto para controlar la respuesta inflamatoria en la córnea31. Se obtuvieron pruebas claras de esta actividad utilizando un modelo de ratón knockout que, al carecer de estas enzimas, produce efectos inflamatorios amplificados. En este estudio, el restablecimiento de la homeostasis corneal se consigue mediante la administración tópica ocular de LXA4.
También se ha informado de que la administración tópica de LXA4 en el tejido corneal favorece la reepitelización y, por tanto, puede reducir el daño tisular tras una lesión29.
El efecto antiinflamatorio de la administración tópica de LXA4 sobre diversos marcadores proinflamatorios en un modelo de uveítis inducida por endotoxinas (UIE) en ratas.36. En este ensayo se demuestra por primera vez que la aplicación tópica de LXA4 estimula significativamente la reducción del proceso inflamatorio en la cámara anterior del ojo. Además, en el mismo estudio se informa de que el tratamiento tópico en ratas con LXA4 (200 ?g/ojo), en comparación con los animales tratados únicamente con vehículo, también reduce el paso de células inflamatorias y la extravasación de proteínas al humor acuoso inducida por el lipopolisacárido. Lipoxina LXA4 es también más potente que la prednisolona en la reducción de la inflamación en el modelo EIU, y eficaz a una dosis 20 veces inferior. Se cree que el posible mecanismo de este efecto se debe a la capacidad de LXA4 bloquear la activación del factor nuclear NF-kappa B y, en consecuencia, inhibir la producción de mediadores proinflamatorios37. Trabajos experimentales recientes también indican que LXA4 ejerce una importante acción antifibrótica, ayudando eficazmente a afinar la resolución hacia la homeostasis tisular38,39. Hay que decir, sin embargo, que el uso terapéutico de LXA4 está gravemente limitado por el rápido metabolismo in vivo y la inestabilidad química. Sin embargo, el proceso de síntesis de derivados estables de LXA4 ya está activo40 y moléculas podrían obtenerse pronto de la preclínica para ser probadas en la investigación clínica, para nuevas e interesantes alternativas terapéuticas en la regulación de la inflamación en diversas enfermedades oculares.
Resolver
El cuadro 1 muestra41 algunos hitos significativos en el estudio de la resolución de la inflamación y los vínculos conexos del desarrollo experimental de mediadores lipídicos. Las resolvinas fueron las primeras moléculas proinflamatorias que se probaron en la clínica.
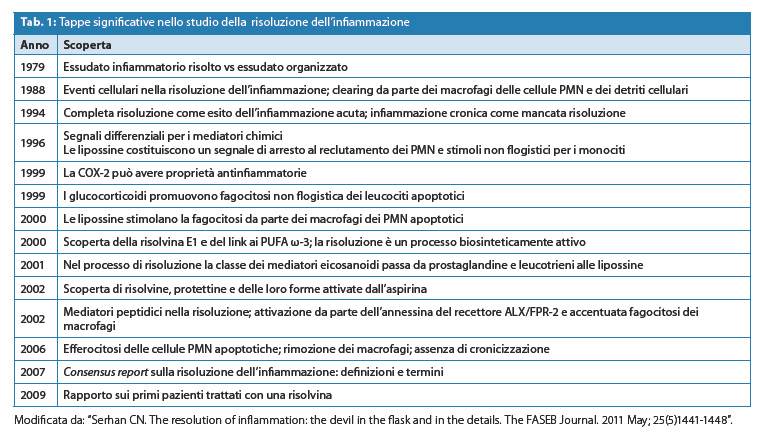
Muchas de las actividades antiinflamatorias de las resolvinas se han demostrado en modelos animales de inflamación en el tratamiento experimental de la colitis, la periodontitis, el daño renal agudo y la peritonitis. En particular, las resolvinas muestran actividad antiinflamatoria al reducir la infiltración de neutrófilos y la expresión de citoquinas proinflamatorias. En un modelo de inflamación alérgica, la RvE1, en cantidades de nanogramos, favorece la resolución de la inflamación en las vías respiratorias. En parte suprimiendo la producción de IL-23 e IL-6 y también aumentando las concentraciones de interferón-? en los pulmones de los animales tratados.42.
En el ámbito ocular, las resolvinas favorecen la producción de lágrimas, evitan la pérdida de integridad de la barrera epitelial corneal e inhiben la transformación de los queratocitos en miofibroblastos. Además, estas moléculas modulan la respuesta celular de los linfocitos T y reducen la apoptosis de las células caliciformes conjuntivales.43-45. En particular, en estudios experimentales realizados en la rata Dartt, la secreción de células caliciformes conjuntivales, componentes importantes en la enfermedad del ojo seco y la alergia ocular, se reduce completamente por la resolución de la inflamación desencadenada por RvD1 y RvE1. Estos buenos resultados preliminares alentaron el inicio del desarrollo oftálmico de las resolvinas. Actualmente se están evaluando análogos sintéticos de la risolvina [RX-10001 (RvE1) y RX-10045] en el tratamiento del ojo seco.46. Recientemente se han obtenido pruebas experimentales del papel que desempeña la resolvina RvD1 en la regulación de la respuesta alérgica ocular47. El estudio muestra que la interacción de RvD1 con el receptor GPR32 activa48 que bloquean la respuesta alérgica estimulada por histamina en las células caliciformes conjuntivales. Estos resultados preliminares positivos abren interesantes perspectivas terapéuticas para las resolvinas en el tratamiento de la conjuntivitis alérgica ocular y otras enfermedades histaminodependientes.
Como es bien sabido, durante la progresión de la neovascularización coroidea se generan diversos mediadores de la inflamación que afectan al epitelio pigmentario de la retina, la membrana de Bruch y otras estructuras retinianas. También se ha observado que, en condiciones de inflamación persistente, las células endoteliales de la retina liberan resolvinas E1 y D1, a lo que sigue una reducción de la expresión de moléculas proinflamatorias y la inhibición de la transmigración de PMN a través de las barreras celulares de la retina coroidea.49. Esto es una confirmación más del papel beneficioso que podrían tener los análogos potenciales de las resolvinas como nuevos agentes terapéuticos en las enfermedades inflamatorias degenerativas del segmento posterior del ojo.
Proteínas y mareas
Las proteínas también desempeñan un papel clave en el control de los procesos inflamatorios, como demuestran los experimentos realizados en modelos animales de peritonitis, isquemia/reperfusión, asma y accidente cerebrovascular.50-53. Los efectos antiinflamatorios de la (neuro)protectina (N)PD1 son tales que protege a las células epiteliales pigmentarias de la retina de la apoptosis inducida por el estrés oxidativo54- 56. Además de las propiedades antiinflamatorias, también se destacaron las propiedades regenerativas del NPD1.57. En el mismo estudio también se planteó la hipótesis de un posible papel de NPD1 en el tratamiento de la córnea neurotrófica.
Las maresinas, aisladas originalmente de exudados de macrófagos murinos, muestran una actividad antiinflamatoria con una potencia muy similar a la resolvina RvE1 y la protectina D158,20. Los efectos antiinflamatorios y proresolutivos de las maresinas se han confirmado en varios experimentos in vivo realizados con la molécula denominada maresina 1 (MAR1) producida por macrófagos humanos, que inhibe la infiltración de neutrófilos en la peritonitis inducida en ratones y potencia la captación de neutrófilos apoptóticos. Los datos adquiridos hasta ahora sugieren una posible aplicación de las maresinas en la modulación de diversos aspectos del proceso inflamatorio y en la resolución del dolor y la regeneración tisular.58. Estas últimas características sitúan a las maresinas en disposición de ser ensayadas en el campo oftalmológico (solas o en combinación con otros fármacos) en aquellas patologías inflamatorias en las que el componente doloroso juega un papel tan predominante que se requiere un abordaje terapéutico adecuado y específico.
Otras opciones para el desarrollo de nuevos fármacos con actividad antiinflamatoria
En los párrafos anteriores se ha descrito un ejemplo de desarrollo farmacológico racional de nuevas clases de moléculas potencialmente útiles en el tratamiento terapéutico de la inflamación. El tiempo dirá si estas nuevas estrategias terapéuticas tendrán el éxito clínico deseado.
Afortunadamente, la experimentación preclínica ha emprendido varias vías en la búsqueda de soluciones terapéuticas nuevas y eficaces para combatir diversas enfermedades inflamatorias, tanto agudas como crónicas.
Antagonistas de las quimiocinas
El sistema inmunitario está implicado directa o indirectamente en numerosas enfermedades oculares de los segmentos anterior y posterior del ojo: queratitis inducida por virus y bacterias, uveítis infecciosa y no infecciosa (autoinmune), síndrome del ojo seco, acontecimientos oncogénicos como el melanoma uveal, rechazo de trasplantes de córnea. Otras enfermedades son la degeneración macular asociada a la edad, el glaucoma, la degeneración coriorretiniana y la retinopatía autoinmune.
La inflamación es fundamental en el desarrollo de respuestas inmunitarias, tanto en condiciones normales como patológicas, y ahora hay pruebas de que el complejo sistema de quimiocinas no está bien regulado en este tipo de enfermedades inmunodependientes.
Las quimiocinas, pequeños péptidos de 8-12 kDa con acción quimiotáctica, son producidas por diferentes tipos celulares en los focos de inflamación, y están implicadas en la adhesión de leucocitos en el endotelio activado y la posterior transmigración y extravasación hacia los tejidos inflamados. Entre las familias de receptores de quimioquinas CXCR3 es probablemente la que desempeña un papel decisivo en el desarrollo de enfermedades autoinmunes, ya que produce, en determinados tejidos, ciclos de amplificación local de la inflamación con empeoramiento relativo del cuadro clínico patológico59. En consecuencia, CXCR3 se ha convertido en una diana muy prometedora para la descubrimiento de fármacos que condujo a la identificación y desarrollo de varias moléculas antagonistas con potencial aplicación clínica en el tratamiento de la inflamación crónica60,61. Una de estas moléculas, denominada T487, alcanzó la fase IIa de desarrollo clínico para el tratamiento de la psoriasis. Desgraciadamente, la falta de eficacia hizo que se suspendieran sus pruebas posteriores. Este resultado negativo, atribuido a la escasa afinidad de la molécula por su receptor diana, no ha afectado a la posibilidad de seguir ensayando esta interesante estrategia terapéutica.62. ?
El estudio experimental del papel de las quimiocinas y sus receptores en la patogénesis de las enfermedades oculares causadas por inflamación aguda y crónica es bastante nuevo.
Recientemente, se ha determinado la expresión de ciertas quimiocinas, incluida la CXCR3, tanto en la película lagrimal como en la superficie ocular de pacientes con ojo seco y especialmente con síndrome de Sjögren63. Recientemente64Además, se ha demostrado que la superficie ocular de los ratones que carecen de receptores de quimiocinas es menos susceptible a los daños causados por la inflamación debido a la incapacidad de las células CD4 de+Los linfocitos T (linfocitos T auxiliares, cuya función principal es organizar la respuesta inmunitaria) se dirigen a este tejido en respuesta al estrés de la desecación. De este modo se evita la activación del bucle de amplificación que conduce a la inflamación crónica y al consiguiente agravamiento de la patología ocular. Estas observaciones preliminares apuntan al uso terapéutico de los antagonistas de las quimiocinas también en el tratamiento de la inflamación en la patología del ojo seco.
Recientemente, se ha utilizado con éxito en trasplantes de córnea un antagonista altamente selectivo de los receptores de quimioquinas CCR5 y CXCR3, el producto denominado TAK-77965,66. En este estudio, el producto se inyectó directamente en el estroma de la córnea.
Sennlaub et al. (2013) plantearon la hipótesis de que67Por primera vez, se ha observado que en ratones knockout que carecen del receptor CXCR1, la quimioquina CCL2, también conocida como proteína quimiotáctica de monocitos 1 (MCP-1), aumenta en ojos con atrofia geográfica. Además, se observó que los monocitos CCR2+ son particularmente reclutados en la lesión atrófica. La acumulación de CCL2 y CCR2+ es mucho más pronunciada en los ratones que carecen del receptor CXCR1, que desarrollan inflamación subretiniana y degeneración de los fotorreceptores. La inhibición de CCL2/CCR2+ podría, por tanto, representar una diana terapéutica adicional para el control de la inflamación crónica en enfermedades subretinianas como la DMAE tanto en su forma atrófica como neovascular.
Inhibidores de la fosfodiesterasa 4
Los inhibidores de la fosfodiesterasa 4 (PDE4) y otros agentes terapéuticos capaces de aumentar los niveles de monofosfato de adenosina cíclico (AMPc) desempeñan un papel muy importante en el sistema inmunitario68. En general, se trata de moléculas que estimulan efectos supresores sobre las acciones deletéreas ejercidas por las células inflamatorias69. En los últimos años, ha habido una serie de ensayos experimentales que demuestran que el AMPc también está implicado en la resolución de la inflamación70-73. En estos estudios se informó de que el AMPc estimula la transición de macrófagos proinflamatorios a macrófagos que resuelven la inflamación. Además, en modelos experimentales de inflamación mediada por neutrófilos y eosinófilos, se ha observado que el aumento de AMPc estimulado por la administración de Rolipram, un inhibidor selectivo de la fosfodiesterasa, u otros fármacos miméticos del AMPc, da lugar de forma concluyente a la resolución de la inflamación. Recientemente, esta posible estrategia terapéutica para contrarrestar la inflamación mediante agentes específicos estimulantes del AMPc se presentó en el congreso ARVO 2013. En este estudio74Mediante estudios farmacocinéticos y preclínicos in vitro e in vivo, se demuestra que una formulación acuosa que contiene un inhibidor de la PDE4, administrada por vía tópica en el ojo del conejo, es capaz de alcanzar concentraciones de fármaco suficientemente adecuadas en la córnea, la conjuntiva y la glándula lagrimal. Este estudio preliminar sugiere que los inhibidores de la fosfodiesterasa-4 pueden seguir explorándose como fármacos potenciales en el tratamiento de la inflamación de la superficie ocular.
Terapias celulares en el tratamiento de la inflamación ocular
Una vía radicalmente distinta del enfoque farmacológico, descrito anteriormente, en el tratamiento de las enfermedades inflamatorias oculares podría proceder en el futuro de la terapia celular.
En los últimos años ha crecido el interés por la posible aplicación de la terapia celular en determinadas enfermedades oculares que inciden de forma importante en el riesgo de discapacidad visual. Naturalmente, en este tratamiento terapéutico específico, al considerarse el ojo un órgano inmunoprivilegiado, se supone que existe un menor riesgo de rechazo por parte del sistema inmunitario. En una revisión reciente75 se destacan aquellas terapias celulares que podrían tener una alta probabilidad de ser utilizadas especialmente en el campo de la inflamación intraocular.
La terapia celular puede dividirse en dos grandes clases: una, mediante el uso de células madretiene por objeto remodelar la estructura y la funcionalidad relativa de tejidos y células específicos; la otra, utilizando células inmunitarias en el papel de potenciales inmunomoduladores de la inflamación, se dirige a restablecer la homeostasis inmunológica controlando aquellos efectos nocivos causados por patologías inflamatorias y que han sido ampliamente descritos por varios autores en los dos volúmenes monográficos "Inflamación: clínica y terapia", publicados por "l'Oculista Italiano".
Uno de los principales campos de la investigación con células madre está dirigido a restaurar la visión en pacientes con enfermedades degenerativas de la retina. La implantación de células madre en este tipo de patologías ha alcanzado un grado de desarrollo muy avanzado76. Otro campo oftalmológico en el que la tecnología y el uso clínico de células madre ha avanzado considerablemente es la aplicación de células madre del limbus córnea en las enfermedades de la superficie ocular. El ojo presenta una barrera a la invasión microbiana a la integridad de la superficie ocular en la que el limbus representa la región de conexión entre la conjuntiva y el epitelio corneal, que tienen características distintas77. En particular, el epitelio corneal tiene una capacidad regenerativa extremadamente eficaz tanto en el recambio homeostático normal de las células superficiales como en la respuesta a las lesiones.
Células madre mesenquimales
Se ha propuesto el uso de células madre mesenquimales (CMM) en diversas enfermedades autoinmunes, entre ellas la uveítis. En un modelo experimental preclínico de uveítis realizado en la rata, las células madre mesenquimales demostraron tener un efecto terapéutico78. También se ha explorado el uso de MSC en patologías de la superficie ocular. En estos estudios79,80 las células se administran por vía intraperitoneal o intravenosa. Además, como en realidad no arraigan en la córnea, se cree que las células actúan a través de la secreción de una proteína con actividad antiinflamatoria denominada TSG-6. Los que se acaban de describir son sólo algunos ejemplos en la literatura en los que el uso de células madre mesenquimales se extiende a la terapia ocular. También es evidente que el componente inflamatorio sigue estando en primer plano como principal diana terapéutica en este tipo de tratamiento celular.
Igualmente interesante es el uso potencial de la terapia celular, dirigida a aquellas células inflamatorias que dañan el tejido huésped.
Recientemente se ha demostrado que durante la fase de resolución de la inflamación, las células accesorias, como el células supresoras de derivación mieloide (MDSC) y las células T reguladoras (Treg) son importantes no sólo como factores de resolución, sino también por su capacidad para vincular el sistema inmunitario innato con el adaptativo81.
Células supresoras derivadas de mieloides
Los macrófagos proinflamatorios son importantes mediadores del daño causado en la inflamación intraocular82-84 y son las principales células a bloquear por la terapia anti-TNFa85-87. Sin embargo, como en todos los procesos inflamatorios, subconjuntos de macrófagos se activan durante la evolución de la enfermedad, como se observó en un modelo de uveorretinitis autoinmune experimental (EAU), inducida en ratones C57/BL6. En este modelo, también se demuestra el papel clave de las células supresoras derivadas de mieloides en la resolución de la patología inflamatoria. En estas condiciones experimentales, también existe una alta posibilidad de cronicidad significativa y posterior neovascularización retiniana y subretiniana. En vista de la actividad antiinflamatoria mostrada por las MDSC en diferentes tipos de enfermedades autoinmunes88,89también se ha propuesto el uso de MDSC en la inflamación intraocular crónica, dado que es en estas circunstancias cuando las MDSC se expanden y adquieren actividad antiinflamatoria mediante la liberación de citocinas supresoras90. Así, se demostró que las MDSC inducidas por células del epitelio pigmentado de la retina bloquean eficazmente la proliferación de células T y la producción de citocinas inflamatorias. Además, la administración sistémica de estas células inhibe las respuestas autoreactivas de las células T responsables de la lesión retiniana en el modelo EAU.91. En este modelo, las células T específicas de la retina causan una inflamación local que provoca la ruptura de la barrera hemato-retiniana, la infiltración de leucocitos y, finalmente, el desprendimiento de retina.92.
Una de las principales dificultades en la aplicación de MDSCs en el control de enfermedades inflamatorias intraoculares es la insuficiente disponibilidad de células autólogas. Por ello, la investigación se ha centrado definitivamente en encontrar una solución viable para superar este punto crítico. No hace mucho se publicó un estudio en el que se demostraba que cultivos de precursores de monocitos, aislados de sangre periférica en presencia de prostaglandina E2, producen, de forma sencilla y clínicamente aceptable, un elevado número de MDSC93. También se ha observado que las MDSC pueden obtenerse en grandes cantidades utilizando citocinas de células progenitoras de monocitos. Estos éxitos recientes en el desarrollo de nuevos métodos para generar MDSCs ofrecen buenas oportunidades para probar clínicamente la eficacia de las células supresoras derivadas de mieloides en enfermedades inflamatorias intraoculares particulares en un futuro próximo.
- Células T reguladoras
Células T reguladoras (Treg), una subpoblación de linfocitos T CD4+ CD25+ que coexpresan el factor de transcripción Foxp3.94regulan la respuesta inmunitaria mediante la secreción de citocinas inmunosupresoras y pro-respuesta (IL10 y TGF-?), lo que las hace indispensables para restablecer la homeostasis inmunitaria95,96. Precisamente por esta característica, la perspectiva de utilizar estas células en la terapia de determinadas enfermedades inflamatorias es un avance que se considera bastante lógico e interesante. Hasta la fecha, ya se ha puesto de manifiesto el papel ventajoso de la utilización de las Tregs en varios tratamientos de enfermedades inflamatorias como la artritis reumatoide.97esclerosis múltiple98 y aterosclerosis99.
Recientemente se han iniciado tres ensayos clínicos de fase I para evaluar la ausencia de toxicidad de las Treg como terapia celular en la enfermedad injerto contra huésped (EICH) con resultados satisfactorios100,101,102. La administración de Treg en niños con diabetes tipo I fue capaz de ralentizar la progresión de la enfermedad sin causar efectos adversos graves103.
En ausencia de una toxicidad Treg clara y en vista del hecho de que los pacientes con uveítis activa tienen un nivel reducido de Treg circulantes104-106También se ha propuesto la aplicación clínica de las células Treg en el tratamiento de la uveítis. Esto también está respaldado por una serie de tratamientos experimentales in vivo que demuestran que se puede conseguir una buena eficacia en el control de la inflamación intraocular mediante el uso de células Treg107,108. Una de las dificultades encontradas a la hora de trasladar la terapia Treg a la práctica clínica está relacionada principalmente con la alta frecuencia de células T convencionales activadas presentes en la fracción CD4+CD25+ y la limitada disponibilidad de procedimientos estándar de Buenas Prácticas de Fabricación (BPF) para eliminar los contaminantes celulares.109. Otra limitación para su aplicación clínica estaba asociada al reducido número de Treg disponibles en la fase de transferencia.110,102. Se han adoptado varios enfoques para la expansión selectiva de células Treg humanas111-114. Sin embargo, sólo recientemente115 se ha comunicado un procedimiento sólido para la producción de Treg para uso clínico. Estos últimos resultados parecen muy prometedores y podrían iniciar en un futuro próximo una terapia celular con Treg para la modulación eficaz de la inflamación intraocular crónica.
Conclusiones
En las últimas décadas se han desarrollado diversos enfoques terapéuticos para el tratamiento de enfermedades oculares que antes se consideraban difíciles de curar. Parte de este éxito se debe principalmente a las numerosas evidencias experimentales que han identificado que el proceso inflamatorio desempeña un papel determinante y/o desencadenante en diversas enfermedades oculares. Poco a poco, el campo de la intervención farmacológica/clínica se ha ido abriendo a nuevas soluciones terapéuticas, muchas de las cuales ya se han establecido en la práctica clínica, mientras que otras están aún en proceso de examen o se encuentran en una fase temprana de experimentación oftalmológica.
Se ha trazado un camino y es de esperar, basándose en el escenario analizado hasta ahora, que en el futuro las oportunidades de controlar con éxito el proceso inflamatorio ocular sean mayores que en el pasado.
Antonino Asero
Correo electrónico: Antonino.Asero@sifigroup.com
Bibliografía
1. Streilein JW. Privilegio inmunitario ocular: oportunidades terapéuticas a partir de un experimento de la naturaleza. Nat. Rev. Immunol. 2003 Nov;3(11):879-89.
2. McDermott, Pérez VHuang AJ, et al. 2005. Pathways of corneal and ocular surface inflammation: a perspective from the Cullen symposium. Ocul. 2005 Oct;3(4 Suppl):S131-8
3. Niederkorn JY, Stein-Streilein J. Historia y fisiología del privilegio inmunitario. Ocul. Immunol. Inflamm. 2010 Jan;18(1):19-23.
4. Cheung CM, Vania M, Ang MComparison of aqueous humor cytokine and chemokine levels in diabetic patients with and without retinopathy. Molecular Vision. 2012; 18:830-837.
5. Gronert K. Resolución, el grial de la inflamación ocular sana. Exp. Eye Res. 2010 Oct;91(4):478-85.
6. Alessandri AL, Sousa LP, Lucas CDResolución de la inflamación: mecanismos y oportunidades para el desarrollo de fármacos. Pharmacol Ther. 2013 Ago;139(2):189-212
7. Gilroy DW, Lawrence T, Perretti M, et al. Resolución inflamatoria: nuevas oportunidades para el descubrimiento de fármacos. Nat Rev Drug Discov. 2004;3(5):401-16.
8. Rossi AGHallett JM, Sawatzky DAModulation of granulocyte apoptosis can influence the resolution of inflammation. Biochem Soc Trans. 2007 Abr;35(Pt 2):288-91.
9. Hallett JM, Leitch AE, Riley NANovel pharmacological strategies for driving inflammatory cell apoptosis and enhancing the resolution of inflammation. Trends Pharmacol Sci. 2008;29(5):250-7.
10. Serhan CN, Brain SD, Buckley CD, et al. Resolución de la inflamación: estado del arte, definiciones y términos. FASEB J. 2007. 21, 325-332.
11. Duffin RLeitch AE, Fox S. Targeting granulocyte apoptosis: mechanisms, models, and therapies. Immunol Rev. 2010 Jul;236:28-40.
12. Serhan CN. Resolution phase of inflammation: novel endogenous anti-inflammatory and proresolving lipid mediators and pathways. Annu Rev Immunol. 2007;25:101-37.
13. Serhan CN, Chiang N. Mediadores lipídicos endógenos pro-resolutivos y anti-inflamatorios: un nuevo género farmacológico. Br J Pharmacol. 2008 Mar;153 Suppl 1:S200-S215.
14. Serhan CN, Chiang N, Van Dyke TE. Resolución de la inflamación: mediadores lipídicos duales antiinflamatorios y pro-resolución. Nat Rev Immunol. 2008 mayo;8(5):349-61.
15. Serhan CN, Petasis NA, 2011. Resolvinas y protectinas en la resolución de la inflamación. Chem Rev. 2011 Oct 12;111(10):5922-43.
16. Levy BD, Zhang QYBonnans C, et al. The endogenous pro-resolving mediators lipoxin A4 and resolvin E1 preserve organ function in allograft rejection. Prostaglandinas Leucot Essent Ácidos grasos. 2011;84(1-2):43-50.
17. Souza DG, Fagundes CT, Amaral FA, et al. El papel requerido de la lipoxina A4 producida endógenamente y la anexina-1 para la producción de IL-10 y la hiporrespuesta inflamatoria en ratones.. J Immunol. 2007;15;179(12):8533-43.
18. Conte FP, Menezes-de-Lima O Jr, Verri WA Jr, et al. Lipoxin A(4) attenuates zymosan-induced arthritis by modulating endothelin-1 and its effects. Br J Pharmacol. 2010;161(4):911-24.
19. Serhan CN, Yang R, Martinod K, et al. Maresins: novel macrophage mediators with potent antiinflammatory and proresolving actions. J Exp Med. 2009;206, 15-23.
20. Schwab JM, Chiang N, Arita M, et al. Resolvin E1 and protectin D1 activate inflammation-resolution programmes. Nature Letters, 2008;447:869-75.
21. Chiang N, Fredman G, Backhed F, et al. Infection regulates pro-resolving mediators that lower antibiotic requirements. Nature. 2012;484: 524-528.
22. Xu ZZ, Zhang L, Liu T, et al. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med. 2010;16(5):592-7, 1p following 597.
23. Serhan CN, Hamberg M, Samuelsson B. Lipoxins: novel series of biologically active compounds formed from arachidonic acid in human leukocytes. Proc Natl Acad Sci USA. 1984; 81(17): 5335-5339.
24. Chiang N, Arita M, Serhan CN. Circuitos antiinflamatorios: lipoxina, lipoxinas activadas por aspirina y su receptor ALX. Prostaglandinas Leucot Essent Ácidos grasos. 2005;73(3-4):163-77.
25. Chiang N, Serhan CN, Dahlén SEThe lipoxin receptor ALX: potent ligand-specific and stereoselective actions in vivo. Pharmacol Rev. 2006;58(3):463-87.
26. Godson C, Brady HR. Lipoxinas: ¿nuevas terapias antiinflamatorias? Curr Opin Investig Drugs. 2000;1(3):380-5.
27. Maderna P, Godson C, Taking insult from injury: lipoxins and lipoxin receptor agonists and phagocytosis of apoptotic cells. Prostaglandins Leukot Essent Fatty Acids. 2005 Sep-Oct;73(3-4):179-87.
28. Fierro IM, Colgan SP, Bernasconi GLipoxin A4 and aspirin-triggered 15-epi-lipoxin A4 inhibit human neutrophil migration: comparisons between synthetic 15 epimers in chemotaxis and transmigration with microvessel endothelial cells and epithelial cells. J Immunol. 2003 Mar 1;170(5):2688-94.
29. Gronert K. Lipoxinas en el ojo y su papel en la cicatrización de heridas. Prostaglandinas Leucot Essent Ácidos grasos. 2005 Sep-Oct;73(3-4):221-9.
30. Bazan NG. La supervivencia celular importa: señalización del ácido docosahexaenoico, neuroprotección y fotorreceptores. Trends Neurosci. 2006;29,263- 271.
31. Biteman B, Hassan IR, Walker E, et al. Interdependence of lipoxin A4 and heme-oxygenase in counter-regulating inflammation during corneal wound healing. FASEB J. 2007 Jul;21(9):2257-66.
32. Qin Q, Patil KA, Gronert K, et al. Neuroprotectin D1 inhibits retinal ganglion cell death following axotomy. Prostaglandins Leukot. Essent. Fatty Acids. 2008; 79, 201-207.
33. Bazan NG, 2009. Neuroprotectin D1-mediated anti-inflammatory and survival signaling in stroke, retinal degenerations, and Alzheimer's disease. J. Lipid. Res. 2009 Abr;50 (Suppl.), S400-S405
34. Calandria JM, Marcheselli VL, Mukherjee PK, et alSelective survival rescue in 15-lipoxygenase-1 deficient retinal pigment epithelial cells by the novel docosahexaenoic acid-derived mediator, neuroprotectin D1. J. Biol. Chem. 2009; 284, 17877-17882.
35. Kenchegowda S, Bazan HE. Importancia de los mediadores lipídicos en las lesiones y la reparación de la córnea. J Lipid Res. 2010 mayo;51(5):879-91.
36. Medeiros R, Rodrigues GB, Figueiredo CPMecanismos moleculares de los efectos antiinflamatorios tópicos de la lipoxina A(4) en la uveítis inducida por endotoxina. Mol Pharmacol. 2008;74(1):154-61.
37. József L, Zouki C, Petasis NALipoxin A4 and aspirin-triggered 15-epi-lipoxin A4 inhibit peroxynitrite formation, NF-kappa B and AP-1 activation, and IL-8 gene expression in human leukocytes. Proc Natl Acad Sci U S A. 2002 Oct 1;99(20):13266-71.
38. Rodgers K, McMahon B, Mitchell D, et al. Lipoxin A4 modifies platelet-derived growth factor-induced pro-fibrotic gene expression in human renal mesangial cells, Am. J. Pathol. 2005;167 683-694.
39. Martins V, Valença SS, Farias-Filho F., et al. ATLa, an aspirin-triggered lipoxin A4 synthetic analog, prevents the inflammatory and fibrotic effects of bleomycin-induced pulmonary fibrosis, J. Immunol. 2009;182 5374-5381.
40. Guilford WJ, Parkinson JF Análogos de 3-oxa-lipoxina A4 resistentes a la beta-oxidación de segunda generación. Prostaglandinas Leucot Essent Ácidos grasos. 2005 Sep-Oct;73(3-4):245-50.
41. Serhan CN. La resolución de la inflamación: el diablo en el matraz y en los detalles. The FASEB Journal. 2011 Mayo; 25(5)1441-1448.
42. Haworth O, Cernadas M, Yang R, et al. Resolvin E1 regulates interleukin-23, interferon-gamma and lipoxin A4 to promote resolution of allergic airway inflammation. Nat Immunol 2008, 9:873-879.
43. Li N, He J, Schwartz CE, et al. Resolvin E1 improves tear production and decreases inflammation in a dry eye mouse model. J. Ocul. Pharmacol. Ther, 26, 431-439 (2010).
44. Dependence of resolvin-induced increases in corneal epithelial cell migration on EGF receptor transactivation. Invest Ophthalmol Vis Sci (2010b). 51, 5601-5609.
45. Dartt DA, Hodges RR, Li DConjunctival Goblet Cell Secretion Stimulated by Leukotrienes Is Reduced by Resolvins D1 and E1 To Promote Resolution of Inflammation. J Immunol. 2011 Abr 1;186(7):4455-66.
46. de Paiva CS, Schwartz CE, Gjorstrup P, et al. Resolvin E1 (RX-10001) reduces corneal epithelial barrier disruption and protects against goblet cell loss in a murine model of dry eye. Cornea 2012;31:1299-1303.
47. Li D, Hodges RR, Jiao JResolvin D1 and aspirin-triggered resolvin D1 regulate histamine-stimulated conjunctival goblet cell secretion. Mucosal Immunol. 2013;6(6):1119-30.
48. Krishnamoorthy S, Recchiuti A, Chiang N, et al. Resolvin D1 Receptor Stereoselectivity and Regulation of Inflammation and Proresolving MicroRNAs. Am J Pathol. 2012; 180(5): 2018-2027.
49. Tian H, Lu Y, Sherwood AM, et al. Resolvins E1 and D1 in Choroid-Retinal Endothelial Cells and Leukocytes: Biosynthesis and Mechanisms of Anti-inflammatory Actions. Invest. Ophthalmol. Vis. Sci. 2009; 50(8):3613-20.
50. Marcheselli VL, Hong S, Lukiw WJ, et al. Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression. J Biol Chem. 2003. 278, 43807-43817.
51. Bannenberg GL, Chiang N, Ariel A, et al. Molecular circuits of resolution: formation and actions of resolvins and protectins. J Immunol. 2005; 174, 4345-4355.
52. Duffield JS, Hong S, Vaidya VS, et al. Resolvin D series and protectin D1 mitigate acute kidney injury. J Immunol. 2006;177, 5902-5911.
53. Levy BD, Kohli P, Gotlinger K, et al. Protectin D1 is generated in asthma and dampens airway inflammation and hyperresponsiveness. J Immunol. 2007. 178, 496-502.
54. Bazan NG. Neuroprotectina D1 (NPD1): un mediador derivado del DHA que protege el cerebro y la retina frente al estrés oxidativo inducido por lesiones celulares. Brain Pathol. 2005;15(2):159-66.
55. Mukherjee PK, Marcheselli VL, Serhan CN, et al. Neuroprotectin D1: A docosatriene-derived docosahexaenoic acid protects human retinal pigment epithelial cells from oxidative stress. PNAS, 2004;101(22):8491-8496.
56. Calandria JM, Mukherjee PK, de Rivero Vaccari JC, et al. Ataxin-1 Poly(Q)-induced proteotoxic stress and apoptosis are attenuated in neural cells by docosahexaenoic acid-derived Neuroprotectin D1. J Biol Chem, 2012;287:23726-39.
57. Cortina MS, He J, Russ T, et al. Neuroprotectin D1 restores corneal nerve integrity and function after damage from experimental surgery. Invest Ophthalmol Vis Sci. 2013;54:4109-4116.
58. Serhan CN, Dalli J, Karamnov S, et al. Macrophage proresolving mediator maresin 1 stimulates tissue regeneration and controls pain. PHASEB J. 2012;26(4):1755-65.
59. Lacotte S, Brun S, Muller S, et al. CXCR3, inflammation, and autoimmune diseases. Ann N Y Acad Sci. 2009;1173:310-7.
60. Wijtmans M, Verzijl D, Leurs R, et al. Towards small-molecule CXCR3 ligands with clinical potential. Chem Med Chem 2008, 3:861-872.
61. Crosignani S, Missotten M, Cleva C, et al. Discovery of a novel series of CXCR3 antagonists. Bioorg Med Chem Lett 2010, 20:3614-3617.
62. Jenh CH, Cox MA, Cui LSCH 546738 atenúa el desarrollo de enfermedades autoinmunes y retrasa el rechazo de injertos. BMC Immunol. 2012 Ene 10;13(1):2.
63. Yoon KC, Park CS, You IC, et al. Expression of CXCL9, -10, -11, and CXCR3 in the tear film and ocular surface of patients with dry eye syndrome. Invest Ophthalmol Vis Sci. 2010;51: 643-650.
64. Coursey TG, Gandhi NB, Volpe EA, et al. Chemokine Receptors CCR6 and CXCR3 Are Necessary for CD4+ T Cell Mediated Ocular Surface Disease in Experimental Dry Eye Disease. Plos One. 2013;8;11, e78508.
65. Perez VL, Saeed AM, Tan Y, et al. The eye: A window to the soul of the immune system. J Autoimmun. 2013 Sep;45:7-14.
66. Gao P, Zhou XY, Yashiro-Ohtani Y, et al. The unique target specificity of a nonpeptide chemokine receptor antagonist: selective blockade of two Th1 chemokine receptors CCR5 and CXCR3. J Leukoc Biol 2003;73:273-80.
67. Sennlaub F, Auvynet C, Calippe BCCR2(+) monocytes infiltrate atrophic lesions in age-related macular disease and mediate photoreceptor degeneration in experimental subretinal inflammation in Cx3cr1 deficient mice. EMBO Mol Med. 2013 Nov;5(11):1775-93
68. Sousa LP, Alessandri AL, Pinho V, et al. Estrategias farmacológicas para resolver la inflamación aguda. Current Opinion in Pharmacology, 2013; 13: 1-7.
69. Teixeira MM, Gristwood RW, Cooper N, et al. Phosphodiesterase (PDE)4 inhibitors: anti-inflammatory drugs of the future? Trends Pharmacol Sci 1997, 18:164-171.
70. Sousa LP, Carmo AF, Rezende BM, et al. Cyclic amp enhances resolution of allergic pleurisy by promoting inflammatory cell apoptosis via inhibition of PI3K/ Akt and NF-kappaB. Biochem Pharmacol 2009, 78:396-405.
71. Sousa LP, Lopes F, Silva DM, et al. PdE4 inhibition drives resolution of neutrophilic inflammation by inducing apoptosis in a PKA-PI3K/Akt- dependent and NF-kappa B-independent manner. J Leukoc Biol 2010, 87:895-904.
72. Bystrom J, Evans I, Newson J, et al. Resolution-phase macrophages possess a unique inflammatory phenotype that is controlled by cAMP. Blood 2008, 112:4117-4127.
73. Rajakariar R, Newson J, Jackson EK, et al. Nonresolving inflammation in gp91phoxS/S mice, a model of human chronic granulomatous disease, has lower adenosine and cyclic adenosine 50-monophosphate. J Immunol 2009, 182:3262-3269.
74. Gale DC, Sychterz CJ, Rodgers C, et al. Ocular and Systemic Pharmacokinetics of a PDE4 Inhibitor Following Topical Administration (Eyedrop) in Male Dutch-Belted Rabbits. ARVO abstract no. 5060, 2013.
75. Forrester JV, Steptoe RJ, Klaska IPTerapias celulares para la inflamación ocular. Prog Retin Eye Res. 2013 Jul;35:82-101.
76. Medina RJ, Archer DB, Stitt, AW. Eyes open to stem cells: safety trial may pave the way for cell therapy to treat retinal disease in patients. Stem Cell Res Ther. 2011 dic 7;2(6):47.
77. Vasania VS, Prasad P, Gill RK, et al. Molecular and cellular characterization of expanded and cryopreserved human limbal epithelial stem cells reveal unique immunological properties. Exp. Eye Res. 2011;92, 47-56.
78. Zhang, X, Ren X, Li G, et al. Mesenchymal stem cells ameliorate experimental autoimmune uveoretinitis by comprehensive modulation of systemic autoimmunity. Invest. Ophthalmol. Vis. Sci. 2011; 52, 3143-3152.
79. Oh JY, Roddy GW, Choi H, et al. Anti-inflammatory protein TSG-6 reduces inflammatory damage to the cornea following chemical and mechanical injury. Proc. Natl. Acad. Sci. U. S. A. 2010; 107, 16875-16880.
80. Roddy GW, Oh JY, Lee R, et al. Action at a distance: systemically administered adult stem/progenitor cells (MSCs) reduce inflammatory damage to the cornea without engraftment and primarily by secretion of TNF-alpha stimulated gene/protein 6. Stem Cells. 2011;29, 1572-1579.
81. Ortega-Gómez A, Perretti M, Soehnlein O. Resolución de la inflamación: una visión integrada EMBO Mol Med. 2013; 5(5): 661-674.
82. Forrester JV, Mcmenamin PG, Holthouse I, et al. Localization and characterization of major histocompatibility complex class IIpositive cells in the posterior segment of the eye: implications for induction of autoimmune uveoretinitis. Invest. Ophthalmol. Vis. Sci. 1994; 35, 64-77.
83. Forrester JV, Huitinga I, Lumsden L, et al. Marrow-derived activated macrophages are required during the effector phase of experimental autoimmune uveoretinitis in rats. Curr. Eye Res. 1998;17, 426-437.
84. Jiang HR, Lumsden L, Forrester JV. Macrophages and dendritic cells in IRBP-induced experimental autoimmune uveoretinitis in B10RIII mice. Invest. Ophthalmol. Vis. Sci. 1999;40, 3177-3185.
85. Dick AD, Mcmenamin PG, Korner H, et al. Inhibition of tumor necrosis factor activity minimizes target organ damage in experimental autoimmune uveoretinitis despite quantitatively normal activated T cell traffic to the retina. Eur. J. Immunol. 1996; 26,1018-1025.
86. Dick AD, Carter D, Robertson MControl of myeloid activity during retinal inflammation. J Leukoc Biol. 2003 Ago;74(2):161-6.
87. Dick AD, Forrester JV, Liversidge J, et al. The role of tumour necrosis factor (TNF-alpha) in experimental autoimmune uveoretinitis (EAU). Prog. Retin. Eye Res. 2004;23, 617-637.
88. Zhu B, Bando Y, Xiao S, et al. CD11b+ Ly-6C(hi) suppressive monocytes in experimental autoimmune encephalomyelitis. J. Immunol. 2007; 179, 5228-5237.
89. Moline-Velazquez V, Cuervo H, Vila-Del Sol V, et al. Myeloid-derived suppressor cells limit the inflammation by promoting T lymphocyte apoptosis in the spinal cord of a murine model of multiple sclerosis. Brain Pathol. 2011; 21, 678-691.
90. Ray P, Arora M, Poe SL, et al. Lung myeloid-derived suppressor cells and regulation of inflammation. Immunol. Res. 2011; 50, 153-158.
91. Tu Z, Li Y, Smith D, et al. Myeloid suppressor cells induced by retinal pigment epithelial cells inhibit autoreactive T cell responses that lead to experimental autoimmune uveitis. Invest. Ophthalmol. Vis. Sci. 2012; 53, 959-966.
92. Kerr EC, Raveney BJ, Copland DA, et al. Analysis of retinal cellular infiltrate in experimental autoimmune uveoretinitis reveals multiple regulatory cell populations. J Autoimmun. 2008;31:354-361.
93. Obermajer N, Kalinski P. Generation of myeloid-derived suppressor cells using prostaglandin E2. Transplantation Research 2012, 1:15.
94. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061.
95. Un papel esencial para la interleucina 10 en la función de las células T reguladoras que inhiben la inflamación intestinal. J Exp Med .1999;190:995-1004.
96. Fahlen L, Read S, Gorelik L, et al. T cells that cannot respond to TGF-beta escape control by CD4(+)CD25(+) regulatory T cells. J Exp Med. 2005; 201: 737-746.
97. Cao D, Malmstrom V, Baecher-Allan C, et al. Isolation and functional characterization of regulatory CD25brightCD4+ T cells from the target organ of patients with rheumatoid arthritis. Eur J Immunol. 2003; 33: 215-223.
98. Viglietta V, Baecher-Allan C, Weiner HL, et al. Pérdida de supresión funcional por células T reguladoras CD4+CD25+ en pacientes con esclerosis múltiple. J Exp Med. 2004;199: 971-979.
99. Ait-Oufella H, Salomon BL, Potteaux S, et al. Natural regulatory T cells control the development of atherosclerosis in mice. Nat Med. 2006;12: 178-180.
100. Trzonkowski P, Bieniaszewska M, Juscinska J, et al. First-in-man clinical results of the treatment of patients with graft versus host disease with human ex vivo expanded CD4+CD25+Células reguladoras CD127-T. Clin Immunol 2009;133(1):22-26.
101. Brunstein CG, Miller JS, Cao Q, et al. Infusión de células reguladoras T expandidas ex vivo en adultos trasplantados con sangre de cordón umbilical: Perfil de seguridad y cinética de detección. Blood 2010; 117:1061-1070.
102. Di Ianni M, Falzetti F, Carotti A, et al. Tregs prevent GVHD and promote immune reconstitution in HLA-haploidentical transplantation. Blood. 2011; 117: 3921-3928.
103. Marek-Trzonkowska N, My?liwec M, Siebert J, et al. Clinical application of regulatory T cells in type 1 diabetes. Pediatr Diabetes. 2013;14(5):322-32.
104. Chen L, Yang P, Zhou H, et al. Diminished frequency and function of CD4+CD25 high regulatory T cells associated with active uveitis in Vogt-Koyanagi-Harada syndrome. Invest. Ophthalmol. Vis. Sci. 2008; 49, 3475-3482.
105. Nanke Y, Kotake S, Goto M, et al. Disminución de los porcentajes de células T reguladoras en sangre periférica de pacientes con enfermedad de Behcet antes del ataque ocular: un posible marcador predictivo del ataque ocular. Mod. Rheumatol. 2008; 18, 354-358.
106. Yeh S, Li Z, Forooghian F, et al. CD4+Foxp3+ T-regulatory cells in noninfectious uveitis. Arch Ophthalmol. 2009 Abr;127(4):407-13.
107. Larson T, Nussenblatt RB, Sen HN. Emerging drugs for uveitis. Expert Opin. Emerg. Drugs. 2011;16, 309-322.
108. Calleja S, Cordero-Coma M, Rodríguez E, et al. Adalimumab induce específicamente las células reguladoras T CD3(+) CD4(+) CD25(high) Foxp3(+) CD127(-) y disminuye los niveles plasmáticos del factor de crecimiento endotelial vascular en la uveítis inmunomediada refractaria: un estudio piloto de intervención no aleatorizado. Eye (Lond) 2012: 26, 468-477.
109. Riley JL, June CH, Blazar BR. Human T Regulatory Cells as Therapeutic Agents: Take a Billion or So of These and Call Me in the Morning. Immunity. 2009; 30(5): 656-665.
110. Brunstein CG, Fuchs EJ, Carter SL, et al. Alternative donor transplantation after reduced intensity conditioning: results of parallel phase 2 trials using partially HLA-mismatched related bone marrow or unrelated double umbilical cord blood grafts. Blood. 2011;118, 282-288.
111. Sagoo P, Ali N, Garg G, et al. Human regulatory T cells with alloantigen specificity are more potent inhibitors of alloimmune skin graft damage than polyclonal regulatory T cells. Sci Transl Med 2011; 3: 83ra42.
112. Peters JH, Hilbrands LB, Koenen HJ, et al. Ex vivo generation of human alloantigen-specific regulatory T cells from CD4(pos) CD25(high) T cells for immunotherapy. PLoS ONE 2008; 3: 2233.
113. Koenen HJ, Fasse E, Joosten I. CD27/CFSE-based ex vivo selection of highly suppressive alloantigen-specific human regulatory T cells. J Immunol 2005; 174: 7573-7583.
114. Banerjee DK, Dhodapkar MV, Matayeva E, et al. Expansión de las células T reguladoras FOXP3high por células dendríticas humanas (DCs) in vitro y después de la inyección de DCs cytokinematured en pacientes con mieloma. Blood 2006; 108: 2655-2661.
115. Putnam AL, Safinia N, Medvec A, et al. Tang. Clinical Grade Manufacturing of Human Alloantigen-Reactive Regulatory T Cells for Use in Transplantation. American Journal of Transplantation 2013;13(11):3010-20.