El nuevo potencial terapéutico de las células madre en oftalmología.
Los recientes avances en medicina regenerativa, en particular las terapias basadas en el uso de cultivos autólogos de células madre adultas, y los primeros ensayos clínicos recientemente propuestos con células madre pluripotentes, han generado entusiasmo y muchos esfuerzos para explorar el nuevo potencial terapéutico tanto de las células madre adultas como de las pluripotentes.
En las últimas décadas, la biología del desarrollo ha dilucidado muchos mecanismos celulares y moleculares que regulan la homeostasis de los tejidos dependientes de células madre, lo que nos ha permitido conocer la base molecular de muchas enfermedades. Muchos tejidos y órganos humanos poseen la capacidad de autorrenovarse y reparar lesiones agudas y crónicas. Estos procesos se basan en la presencia de células madre específicas, que generan progenitores (a menudo denominados células transitoriamente amplificadoras), los cuales generan células terminalmente diferenciadas. Ejemplos típicos de estas transiciones son las células madre hematopoyéticas, que dan lugar a todas las células sanguíneas a través de progenitores mieloides y linfoides, o las células madre epidérmicas, que dan lugar a la epidermis, el folículo piloso y las glándulas sebáceas; las células madre mesenquimales, que derivan de la médula ósea, son capaces de generar todos los tejidos que se encuentran en el segmento óseo (hueso, cartílago, adipocitos, fibroblastos y el estroma que soporta la hematopoyesis), mejor definidas como células madre esqueléticas.
del epitelio corneal, han demostrado restaurar completamente un epitelio corneal gravemente dañado y permitir la recuperación de la visión en pacientes con destrucción corneal causada por quemaduras químicas. Las células madre se aíslan mediante tratamiento enzimático a partir de una biopsia de 1-2 mm del limbo, la delgada zona entre la córnea y la conjuntiva. El limbo es la única zona de la córnea con invaginaciones en forma de papilas, denominadas Vogt Palisades e criptas epiteliales limbaresque contiene muchas células basales pequeñas que carecen de queratina 3, que es específica para la diferenciación corneal. Esta capa basal limbal contiene células que completan lentamente el ciclo celular y forman holoclones, mientras que las células corneales centrales no lo hacen. Se han propuesto muchos marcadores moleculares para identificar las células madre corneales; sin embargo, sólo se ha demostrado la correlación de algunos de ellos con la capacidad de regenerar la córnea a largo plazo.
Poco después del primer informe de aplicación clínica satisfactoria con células madre limbares cultivadas, se propusieron varias docenas de protocolos similares con aplicaciones clínicas relacionadas. Las investigaciones sobre métodos alternativos y patologías susceptibles de tratamiento han contribuido a aumentar nuestros conocimientos en este campo, al tiempo que han aumentado las cuestiones relacionadas con la identificación de las causas de variabilidad relacionadas con los reactivos utilizados para la reconstrucción tisular, la selección de los pacientes incluidos en el tratamiento, los fármacos utilizados en paralelo, el manejo quirúrgico y postoperatorio, y las implicaciones de todo ello en la proporción de resultados positivos, la seguridad y la reproducibilidad de los resultados clínicos.
La separación cultural entre los distintos campos científicos dificulta el establecimiento de criterios multidisciplinares que, sin embargo, son necesarios para una investigación traslacional óptima. En este artículo se intenta proponer algunos criterios (relacionados específicamente con parámetros tanto clínicos como biológicos) para la medicina traslacional con células madre limbares cultivadas.
También ofrecemos una amplia bibliografía que servirá de guía a quienes deseen saber más sobre este campo de investigación.
Selección de pacientes
La reserva de células madre limbales del epitelio corneal disminuye debido a daños hereditarios o adquiridos, lo que provoca una deficiencia parcial o total de células madre limbales (LSCD). Esta definición se refiere a un grupo heterogéneo de patologías que tienen un efecto deletéreo sobre la integridad corneal y el cierre de heridas. Como consecuencia de la depleción de células madre, se produce la invasión de la córnea periférica y central por el epitelio conjuntival. Esta deslocalización tisular induce la neovascularización de una zona ocular normalmente avascular e induce la opacificación corneal, lo que provoca una grave disminución de la agudeza visual o ceguera. La invasión conjuntival puede prevenirse o evitarse mediante la relocalización de células madre corneales obtenidas por trasplante de colgajos generados a partir del cultivo de células limbares autólogas tomadas del ojo no dañado o menos dañado.
[caption id="attachment_1536" align="alignright" width="178"]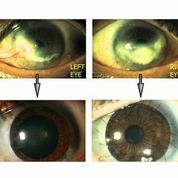 Foto 2. LSD bilateral antes y después del tratamiento (cortesía del Dr. Paolo Rama)[/caption].
Foto 2. LSD bilateral antes y después del tratamiento (cortesía del Dr. Paolo Rama)[/caption].
La selección y preparación adecuadas del "lecho receptor" son de gran importancia para el éxito clínico de los cultivos limbares. Pueden producirse fracasos debido a la gravedad del daño, el grado de inflamación y las complicaciones postoperatorias. Las quemaduras químicas pueden dañar los párpados, la conjuntiva y el aparato lagrimal. En el curso de tales daños, la superficie ocular se inflama crónicamente y la alteración resultante del microambiente puede impedir la absorción de las células madre cultivadas. En el caso de daños extensos de toda la superficie ocular, la reconstrucción de la conjuntiva, que permite el movimiento del globo ocular y la distribución fisiológica de la película lagrimal, debe lograrse antes del trasplante celular. En ausencia de estímulos negativos sistémicos o genéticos, el trasplante de cultivos celulares limbares autólogos puede por sí mismo restaurar parcial o totalmente el macro o microambiente. Esto puede explicar por qué, en superficies oculares gravemente dañadas por quemaduras químicas, el segundo trasplante de epitelio cultivado produce un mayor grado de éxito que el primer trasplante. El primer trasplante de células cultivadas probablemente "normaliza el entorno" mediante la producción de moléculas de matriz como la laminina 5, proteoglicanos y colágeno, la secreción paracrina y autocrina de una cantidad equilibrada de factores de crecimiento, como el TGF alfa, las interleucinas, el PDGF, el factor de crecimiento similar a la insulina 1, el TGF beta, el factor de crecimiento nervioso, el factor de crecimiento básico de fibroblastos y el "cross-talk" epitelial-mesenquimal. A pesar de muchos años de éxitos clínicos demostrados, todavía no tenemos ni idea de cuántas células madre pueden arraigar en el lecho receptor de la lesión. Además, las patologías de la superficie ocular atribuidas a la deficiencia de células madre limbares pueden tener diversas etiologías, pero no se ha demostrado que todas ellas estén asociadas a una depleción total de células madre limbares. De hecho, podrían caracterizarse por un macro y microentorno que no es permisivo para la proliferación y diferenciación adecuadas de las células madre existentes. Los distintos déficits limbares podrían proporcionar "instrucciones de comportamiento" a las células trasplantadas, que guiarían distintas respuestas celulares durante o después del enraizamiento.
Parámetros biológicos
Se han propuesto varios métodos para el cultivo de células madre limbares. La composición del medio de cultivo desempeña un papel importante en la conservación de las células madre limbares, y se han propuesto diferentes mezclas de materiales y reactivos para el cultivo. Entre las diversas propuestas, no está claro cuándo se han aplicado las Buenas Prácticas de Fabricación o BPF (que han entrado en vigor en Europa para estos productos) a los reactivos biológicos destinados a la fabricación de terapias avanzadas (tejidos cultivados).
[caption id="attachment_1537" align="alignleft" width="178"]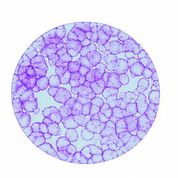 Foto 3. Colonias de células epiteliales obtenidas a partir de una célula madre (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
Foto 3. Colonias de células epiteliales obtenidas a partir de una célula madre (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
De hecho, ni siquiera se han descrito con regularidad los detalles de los criterios utilizados para la selección de los materiales y reactivos apropiados y nunca se ha explicado cómo se consideraron estos materiales adecuados para mantener las células madre en cultivo. En ausencia de estos datos, se hace difícil evaluar la tasa de éxito clínico o la seguridad de cada sistema de cultivo desarrollado, y si las diferencias están relacionadas con la técnica de cultivo o con la selección de lotes individuales de reactivos. Obviamente, la comparación de diferentes condiciones de cultivo no puede mostrar diferencias si las células madre no se mantuvieron en ninguna de las condiciones.
En los últimos años, diversos estudios han propuesto diferentes combinaciones de factores de crecimiento y hormonas en el medio de cultivo. Estos medios pueden inducir la estimulación de diferentes vías metabólicas con una variedad de respuestas celulares tanto en cultivo como tras el trasplante. Para producir un éxito clínico, un cultivo de células corneales debe contener un número suficiente de células madre de queratinocitos, que son esenciales para la renovación de la córnea a largo plazo, en lugar de un epitelio totalmente estratificado en cultivo. Los resultados clínicos obtenidos con diferentes técnicas pueden ayudar a identificar información clave sobre la idoneidad del proceso de cultivo.
El problema de los componentes xenogénicos
[caption id="attachment_1538" align="alignright" width="263"]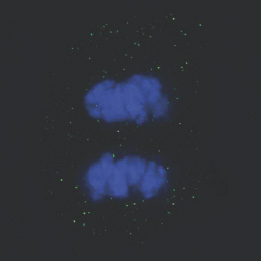 Foto 5. Una célula limbal en mitosis (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
Foto 5. Una célula limbal en mitosis (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
Los medios de cultivo suelen contener materiales de origen animal, como el suero bovino. El suero fetal se utiliza en éste, así como en otros modelos de cultivo celular. Algunos autores han propuesto el uso de suero humano autólogo, con la intención de evitar posibles contaminantes xenogénicos, para sustituir al suero bovino fetal. Sin embargo, es necesario tener en cuenta el contenido variable de hormonas y factores de crecimiento, debido a las diferentes características genéticas de cada individuo, lo que haría que los cultivos no fueran reproducibles, ya que crecerían en medios de cultivo con una composición diferente para cada paciente. Estas diferencias podrían repercutir en el mantenimiento de las células madre y reducirían la fiabilidad de los controles de los cultivos, al imposibilitar la definición de criterios específicos y bien definidos para evaluar la calidad del cultivo celular. El suero fetal bovino utilizado con frecuencia procede de mezclas de diferentes sueros, por lo que se minimiza la variabilidad individual en su contenido; ciertamente, el suero fetal utilizado debe ser analizado exhaustivamente para detectar la ausencia de patógenos de acuerdo con la normativa sanitaria vigente. El uso equivalente de mezclas de sueros humanos podría obviar la variabilidad individual, sin embargo, el riesgo de contaminación por virus, agentes infecciosos o víricos y priones también existe para los reactivos de origen humano y, especialmente en ausencia de barreras entre especies, todo puede transmitirse.
[caption id="attachment_1539" align="alignleft" width="178"]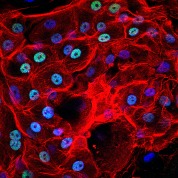 Foto 5. Células corneales vistas con un microscopio de fluorescencia (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
Foto 5. Células corneales vistas con un microscopio de fluorescencia (cortesía del Centro de Medicina Regenerativa "Stefano Ferrari")[/caption].
Otra opción propuesta son los medios de cultivo sintéticos, que, sin embargo, carecen de un gran número de potenciadores fisiológicos, algunos de los cuales son conocidos y podrían producirse en el futuro por síntesis y adición. Hay que tener en cuenta, sin embargo, que muchos de ellos son aún desconocidos y que la purificación (en condiciones GMP) de todas las hormonas y factores de crecimiento necesarios haría inalcanzable el coste de los medios. Consideraciones similares se aplican a muchos otros elementos de los medios de cultivo, a menudo de origen animal y aún no sustituibles si se quieren mantener las funciones celulares, que deben comprobarse cuidadosamente antes de su utilización.
Señales biomecánicas y modificación de superficies
Una estrategia típica, utilizada en terapias con células madre, consiste en reconstruir tejidos artificiales con células cultivadas en biomateriales capaces de "imitar" el microentorno bioquímico y biofísico. in vivo. Para ello, se han propuesto muchos materiales diferentes para cultivar las células, como fibrina, membrana amniótica, plástico o polímeros de diversos tipos. La interacción entre las células madre, el microentorno que las rodea y las fuerzas externas (que representan el "nicho" de las células madre) debe comprenderse bien antes de que las terapias puedan aplicarse clínicamente. El comportamiento celular no sólo se rige por señales químicas. La arquitectura del tejido y las fuerzas mecánicas a las que están sometidas son señales dominantes que rigen las decisiones celulares: las interacciones de adhesión célula-matriz y célula-célula, la organización del citoesqueleto y las fuerzas de tensión que mantienen a las células individuales y a todo el tejido en una forma precisa representan, todas ellas, señales de "arquitectura" biológica. Las conexiones mecánicas entre la matriz y el citoesqueleto permiten a las células ejercer fuerzas de tensión que se transmiten al núcleo celular, cuyo resultado es el desencadenamiento de señales que modulan la adhesión, la difusión superficial, la migración, la proliferación y la diferenciación. En términos más generales, la mecatransducción representa una combinación de señales, incluida la yuxtaposición de estímulos moleculares, topográficos y mecánicos, presentes en la interfaz de interacción. Para estudiar estas interacciones, se utilizaron superficies que exponían grupos moleculares biofuncionales seleccionados o moldes a escala micrométrica específicamente diseñados. Estos ensayos demostraron que la dureza del sustrato, la nanoptopografía de la superficie, la microgeometría y las fuerzas extracelulares, e incluso los flujos de fluidos, pueden tener una influencia importante en la regulación de las actividades de distintos tipos celulares. Por ejemplo, in vivola formación de cicatrices cutáneas activa los factores de crecimiento transformantes y la señalización SMAD, moléculas de adhesión como las integrinas y señales de calcio; o en el caso de los mioblastos, cuando se colocan sobre grandes tiras de hidrogel blando, disminuyen su proliferación y aumentan su índice de fusión.
Medicación durante la intervención y el seguimiento
El tratamiento de los problemas postraumáticos o postoperatorios implica un amplio uso de fármacos. En el caso del tratamiento de los déficits del tallo limbal, el impacto de la toxicidad corneal aguda y crónica de los componentes de los colirios no se tiene debidamente en cuenta en los protocolos de medicina regenerativa. A pesar de ello, un gran número de estudios experimentales y clínicos han demostrado que el uso prolongado de fármacos tópicos puede inducir cambios en la superficie ocular, causando molestias oculares, inestabilidad de la película lagrimal, pérdida de células caliciales, inflamación, metaplasia conjuntival escamosa, apoptosis epitelial y fibrosis subconjuntival. El uso prolongado de anestésicos locales se asocia con un retraso en la reepitelización corneal tras una lesión, alteraciones de la lubricación y de la película lagrimal, inflamación corneal e interrupción de la motilidad epitelial. La lidocaína, uno de los anestésicos más utilizados, ya en dosis de 250 mg/ml (por debajo de la dosis clínica), reduce la eficacia de la cicatrización normal de las heridas. Los vasoconstrictores, que se utilizan generalmente para aumentar la duración de la anestesia local, pueden producir un efecto citotóxico y la deposición de pigmentos, como se señala en la bibliografía para la epinefrina y algunos fármacos antiglaucomatosos de uso común.
Dependiendo de la dosis y el modo de administración, los corticosteroides, que se utilizan ampliamente, tanto por vía sistémica como tópica, en el tratamiento de las afecciones inflamatorias oculares, tienen efectos secundarios que incluyen el retraso o la prevención del cierre de las lesiones corneales. Los antiinflamatorios no esteroideos inhiben la síntesis de prostaglandinas y ejercen un efecto antiinflamatorio equivalente. Estos fármacos se utilizan cada vez más por su efecto analgésico concomitante y su eficacia en las enfermedades alérgicas oculares.
El análisis comparativo de la toxicidad corneal reveló daños celulares, alteraciones de la viabilidad celular, proliferación y migración incluso tras una exposición de corta duración de las células corneales a determinados antiinflamatorios no esteroideos. Otros fármacos de uso común, como los análogos de las prostaglandinas, las gotas antialérgicas o las soluciones polivalentes (especialmente en presencia de conservantes) mostraron efectos tóxicos similares. En particular, los datos científicos sugieren una interpretación de daño irreversible del compartimento proliferativo epitelial, que incluye las células madre; se han descrito efectos sobre la viabilidad celular (con una disminución de hasta 40%), la proliferación, el mantenimiento del grosor corneal, la permeabilidad endotelial, la integridad del ADN y la lubricación, debidos a conservantes comunes como el cloruro de benzalconio (BAC), especialmente en caso de administración repetida o persistencia de estos fármacos en superficies oculares dañadas.
Está claro que todos estos efectos tóxicos se amplifican cuando los fármacos se utilizan antes del enraizamiento completo de una población celular cultivada.
En conclusión, ningún fármaco parece estar exento de toxicidad de algún tipo, por lo que la selección de fármacos en cultivos celulares aplicados y la armonización de dosis y protocolos de administración deben considerarse cuidadosamente para aumentar la relación beneficio/riesgo.
Conclusiones
Los rápidos avances en la investigación con células madre han despertado el interés de gobiernos, medios de comunicación y, por supuesto, pacientes. Su éxito clínico depende de factores exclusivos de las terapias celulares, como los procedimientos de fabricación, la normalización de los protocolos clínicos y farmacológicos y la regulación de la seguridad. Como ya se ha comentado, el éxito de la aplicación clínica de cualquier protocolo de terapia celular requiere la optimización del método de cultivo (sobre todo cuando se trata de células madre) y de los procedimientos quirúrgicos, el control del microentorno en el que van a arraigar las células y un apoyo farmacológico adecuado.
Este escenario se complica aún más con las nuevas normativas sobre aplicaciones clínicas de células y tejidos. Como ocurre con muchos fármacos tradicionales, los cultivos celulares para aplicaciones clínicas deben obtenerse de acuerdo con las normas vigentes sobre buenas prácticas de fabricación (BPF), pero los cultivos celulares son intrínsecamente más complejos y están peor controlados que una molécula pequeña. Debido a su naturaleza biológica, los productos de células vivas no pueden definirse completamente con los mismos métodos que los medicamentos tradicionales. La opción de aplicar las normas de los medicamentos a los cultivos celulares, sin adaptaciones específicas para este campo, no es del todo aceptable. De hecho, esta elección crea problemas tanto a los científicos como a los reguladores. Los investigadores, tanto del mundo académico como de la industria, apenas pueden hacer frente a las nuevas normas europeas sobre medicamentos de terapia avanzada (Reglamento CE nº 1394). En Estados Unidos y otros países industrializados se ha aplicado una normativa similar, aunque no idéntica.
Los productos basados en células vivas presentan muchos retos adicionales, sobre todo en el entorno sanitario actual, altamente regulado, especialmente si se tiene en cuenta que el entramado de normativas se diseñó para la fabricación de tipo químico en el siglo pasado. Además, no hay mucha armonización entre las distintas autoridades reguladoras, lo que aumenta enormemente los problemas en la fabricación y los ensayos clínicos. La conferencia internacional para la armonización de los requisitos técnicos para el registro de productos farmacéuticos de uso humano sólo ha producido acuerdos sobre temas concretos, como la seguridad vírica y algunos otros.
La regulación tiene por objeto aumentar la seguridad y proteger así a los pacientes, y es incuestionable; sin embargo, en el caso de los productos basados en células vivas, a menudo se consigue a expensas de la eficacia, debido a la falta de ajustes específicos del sector. Toda terapia se basa en una relación beneficio/riesgo, por lo que reducir la eficacia de un cultivo celular por debajo de un determinado valor umbral generará un producto biológico más seguro pero inútil. Las terapias basadas en el uso de células vivas son más complejas e intrínsecamente menos controladas que la síntesis de moléculas, debido a su naturaleza biológica, lo que hace que este producto no esté totalmente definido, sino sólo parcialmente, según la normativa "clásica", que exige una ampliación por estos motivos. Por último, muchos productos celulares autólogos específicos de pacientes se "administran frescos", por lo que los ensayos de liberación no pueden completarse todos antes de la administración, lo que nos lleva a la idea de que el producto real es el proceso de fabricación, y la fiabilidad de la fabricación debe evaluarse periódicamente mediante la comparación con células de referencia específicas, determinando los límites de los controles que se obtienen durante la fabricación de tejidos. Estos límites serán más amplios para la fabricación de tejidos a partir de distintos individuos, debido a las diferencias de edad, sexo, estilo de vida y características genéticas individuales, pero deberían ser más estrictos para los tratamientos con donantes a gran escala.
La comprensión de las perspectivas de la medicina regenerativa permitirá conocer la probable configuración futura de las nuevas terapias, sus plazos de desarrollo, así como la planificación de la infraestructura necesaria para facilitar su rápida distribución por las academias y la nueva industria farmacéutica en todo el mundo, con las máximas garantías para los pacientes.
Graziella Pellegrini
Correo electrónico: graziella.pellegrini@unimore.it
Prof. Graziella Pellegrini Profesora de Biología en la Universidad de Módena y Reggio Emilia y Coordinadora de Terapia Celular en el Centro de Medicina Regenerativa "Stefano Ferrari", la profesora Pellegrini ha dedicado gran parte de su actividad científica a la medicina traslacional y al desarrollo de aplicaciones clínicas de células madre cultivadas.
Junto con el profesor Michele De Luca, desarrolló el primer tratamiento con células madre limbares humanas para pacientes con quemaduras graves en la córnea.
Es uno de los miembros fundadores de la IOSS (International Ocular Surface Society).
Referencias bibliográficas
1. Wu SM, Hochedlinger K. Harnessing the potential of induced pluripotent stem cells for regenerative medicine. Nat Cell Biol.13:497-505.
2. Wagers AJ, Weissman IL. Plasticidad de las células madre adultas. Cell. 2004;116:639-648.
3. Tedesco FS, Cossu G. Stem cell therapies for muscle disorders. Curr Opin Neurol. 2012;25:597-603.
4. Seita J, Weissman IL. Células madre hematopoyéticas: autorrenovación frente a diferenciación. Wiley Interdiscip Rev Syst Biol Med. 2010;2:640-653.
5. Claudinot S, Nicolas M, Oshima H, et al. Long-term renewal of hair follicles from clonogenic multipotent stem cells. Proc Natl Acad Sci U S A. 2005;102:14677-14682.
6. Blanpain C, Horsley V, Fuchs E. Epithelial Stem Cells: Turning over New Leaves. Cell .. 2007;128:445-458.
7. Jungebluth P, Alici E, Baiguera S, et al. Tracheobronchial transplantation with a stem-cell-seed bioartificial nanocomposite: a proof-of-concept study. Lancet. 2011;378:1997-2004.
8. White P, Cao X, Frenette PS, et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nat Med. 2013;19:35-42.
9. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6:331-343.
10. Green H, Kehinde O, Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proc Natl Acad Sci U S A. 1979;76:5665-5668.
11. Gallico GG, 3rd, O'Connor NE, Compton CC, et al. Permanent coverage of large burn wounds with autologous cultured human epithelium. N Engl J Med. 1984;311:448-451.
12. De Luca M, Albanese E, Bondanza S, et al. Multicentre experience in the treatment of burns with autologous and allogenic cultured epithelium, fresh or preserved in a frozen state. Quemaduras. 1989;15:303-309.
13. Pellegrini G, Ranno R, Stracuzzi G, et al. The control of epidermal stem cells (holoclones) in the treatment of massive full-thickness burns with autologous keratinocytes cultured on fibrin. Transplantation. 1999;68:868-879.
14. Ronfard V, Rives JM, Neveux Y, et al. Long-term regeneration of human epidermis on third degree burns transplanted with autologous cultured epithelium grown on a fibrin matrix. Transplantation. 2000;70:1588-1598.
15. Mavilio F, Pellegrini G, Ferrari S, et al. Correction of junctional epidermolysis bullosa by transplantation of genetically modified epidermal stem cells. Nat Med. 2006;12:1397-1402.
16. Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis of stem cells and their differentiated progeny in the human ocular surface. J Cell Biol. 1999;145:769-782.
17. Schwab IR. Cultured corneal epithelia for ocular surface disease. Trans Am Ophthalmol Soc. 1999;97:891-986.
18. Tsai RJ, Li L, Chen J. Reconstruction of damaged corneas by transplantation of autologous limbal epithelial cells(1). Am J Ophthalmol. 2000;130:543.
19. Rama P, Bonini S, Lambiase A, et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of patients with total limbal stem cell deficiency. Transplantation. 2001;72:1478-1485.
20. Rama P, Matuska S, Paganoni G, et al. Limbal stem-cell therapy and long-term corneal regeneration. N Engl J Med. 2010;363:147-155.
21. Dua HS, Shanmuganathan VA, Powell-Richards AO, et al. Limbal epithelial crypts: a novel anatomical structure and a putative limbal stem cell niche. Br J Ophthalmol. 2005;89:529-532.
22. Cotsarelis G, Cheng SZ, Dong G, et al. Existence of slow-cycling limbal epithelial basal cells that can be preferentially stimulated to proliferate: implications on epithelial stem cells. Cell. 1989;57:201-209.
23. Di Iorio E, Barbaro V, Ruzza A, et al. Isoforms of DeltaNp63 and the migration of ocular limbal cells in human corneal regeneration. Proc Natl Acad Sci U S A. 2005;102:9523-9528.
24. Priya CG, Prasad T, Prajna NV, et al. Identification of Human Corneal Epithelial Stem Cells on the Basis of High ABCG2 Expression Combined With a LargeN/C Ratio. Microsc Res Tech.76:242-248.
25. Kubota M, Shimmura S, Miyashita H, et al. The anti-oxidative role of ABCG2 in corneal epithelial cells. Invest Ophthalmol Vis Sci.51:5617-5622.
26. Meyer-Blazejewska EA, Kruse FE, Bitterer K, et al. Preservation of the limbal stem cell phenotype by appropriate culture techniques. Invest Ophthalmol Vis Sci.51:765-774.
27. Santos MS, Gomes JA, Hofling-Lima AL, et al. Survival analysis of conjunctival limbal grafts and amniotic membrane transplantation in eyes with total limbal stem cell deficiency. Am J Ophthalmol. 2005;140:223-230.
28. Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet .. 1997;349:990-993.
29. Li DQ, Lee SB, Tseng SC. Differential expression and regulation of TGF-beta1, TGF-beta2, TGF-beta3, TGF-betaRI, TGF-betaRII and TGF-betaRIII in cultured human corneal, limbal, and conjunctival fibroblasts. Curr Eye Res. 1999;19:154-161.
30. Li DQ, Tseng SC. Three patterns of cytokine expression potentially involved in epithelial-fibroblast interactions of human ocular surface. J Cell Physiol. 1995;163:61-79.
31. Touhami A, Grueterich M, Tseng SC. The role of NGF signaling in human limbal epithelium expanded by amniotic membrane culture. Invest Ophthalmol Vis Sci. 2002;43:987-994.
32. Dell S, Peters S, Muther P, et al. The role of PDGF receptor inhibitors and PI3-kinase signaling in the pathogenesis of corneal neovascularization. Invest Ophthalmol Vis Sci. 2006;47:1928-1937.
33. Lambiase A, Aloe L, Mantelli F, et al. Capsaicin-induced corneal sensory denervation and healing impairment are reversed by NGF treatment. Invest Ophthalmol Vis Sci. 2012;53:8280-8287.
34. Qi H, Li DQ, Shine HD, et al. Nerve growth factor and its receptor TrkA serve as potential markers for human corneal epithelial progenitor cells. Exp Eye Res. 2008;86:34-40.
35. Sakimoto T, Sawa M. Metalloproteinases in corneal diseases: degradation and processing. Cornea. 2012;31 Suppl 1:S50-56.
36. Jordan T, Hanson I, Zaletayev D, et al. The human PAX6 gene is mutated in two patients with aniridia. Nat Genet. 1992;1:328-332.
37. Mishra R, Gorlov IP, Chao LY, et al. PAX6, paired domain influences sequence recognition by the homeodomain. J Biol Chem. 2002;277:49488-49494.
38. Tohyama M, Watanabe H, Murakami S, et al. Possible involvement of CD14+ CD16+ monocyte lineage cells in the epidermal damage of Stevens-Johnson syndrome and toxic epidermal necrolysis. Br J Dermatol. 2012;166:322-330.
39. De Luca M, Pellegrini G, Green H. Regeneration of squamous epithelia from stem cells of cultured grafts. Regenerative Med. 2006;1:45-57.
40. Guerra L, Capurro S, Melchi F, et al. Treatment of "stable" vitiligo by timedsurgery and transplantation of cultured epidermal autografts. Arch Dermatol. 2000;136:1380-1389.
41. Sangwan VS, Basu S, Vemuganti GK, et al. Clinical outcomes of xeno-free autologous cultivated limbal epithelial transplantation: a 10-year study. Br J Ophthalmol. 2011;95:1525-1529.
42. Barrandon Y, Green H. Three clonal types of keratinocyte with different capacities for multiplication. Proc Natl Acad Sci U S A. 1987;84:2302-2306.
43. Rochat A, Kobayashi K, Barrandon Y. Localización de células madre de folículos pilosos humanos mediante análisis clonal. Cell .. 1994;76:1063-1073.
44. Shimazaki J, Higa K, Morito F, et al. Factors influencing outcomes in cultivated limbal epithelial transplantation for chronic cicatricial ocular surface disorders. Am J Ophthalmol. 2007;143:945-953.
45. Satake Y, Higa K, Tsubota K, et al. Long-term outcome of cultivated oral mucosal epithelial sheet transplantation in treatment of total limbal stem cell deficiency. Ophthalmology. 2011;118:1524-1530.
46. Shahdadfar A, Haug K, Pathak M, et al. Ex vivo expanded autologous limbal epithelial cells on amniotic membrane using a culture medium with human serum as single supplement. Exp Eye Res.97:1-9.
47. Stacey GN, Cobo F, Nieto A, et al. The development of 'feeder' cells for the preparation of clinical grade hES cell lines: challenges and solutions. J Biotechnol. 2006;125:583-588.
48. Liu ZZ, Chen P, Lu ZD, et al. Enrichment of breast cancer stem cells using a keratinocyte serum-free medium. Chin Med J (Engl). 2011;124:2934-2936.
49. Kormos B, Belso N, Bebes A, et al. Desdiferenciación in vitro de melanocitos de epidermis adulta. PLoS One. 2011;6:e17197.
50. Discher DE, Janmey P, Wang YL. Tissue cells feel and respond to the stiffness of their substrate. Science .. 2005;310:1139-1143.
51. Green H. El nacimiento de la terapia con células cultivadas. Bioensayos. 2008;30:897-903.
52. Carrier P, Deschambeault A, Audet C, et al. Impact of cell source on human cornea reconstructed by tissue engineering. Invest Ophthalmol Vis Sci. 2009;50:2645-2652.
53. Sharma SM, Fuchsluger T, Ahmad S, et al. Comparative analysis of human-derived feeder layers with 3T3 fibroblasts for the ex vivo expansion of human limbal and oral epithelium. Stem Cell Rev. 2012;8:696-705.
54. Oie Y, Hayashi R, Takagi R, et al. A novel method of culturing human oral mucosal epithelial cell sheets using post-mitotic human dermal fibroblast feeder cells and modified keratinocyte culture medium for ocular surface reconstruction. Br J Ophthalmol. 2010;94:1244-1250.
55. Paliwal P, Sharma A, Tandon R, et al. TGFBI mutation screening and genotype-phenotype correlation in north Indian patients with corneal dystrophies. Mol Vis. 2010;16:1429-1438.
56. West MD. Biología celular y molecular del envejecimiento cutáneo. Arch Dermatol. 1994;130:87-95.
57. Hultman CS, Brinson GM, Siltharm S, et al. Los fibroblastos alogénicos utilizados para cultivar autoinjertos epidérmicos persisten in vivo y sensibilizan al receptor del injerto para un rechazo acelerado del segundo conjunto. J Trauma. 1996;41:51-58; discusión 58-60.
58. Halder G, Dupont S, Piccolo S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nat Rev Mol Cell Biol. 2012;13:591-600.
59. Shi ZD, Tarbell JM. Fluid flow mechanotransduction in vascular smooth muscle cells and fibroblasts. Ann Biomed Eng. 2011;39:1608-1619.
60. Weinbaum S, Guo P, You L. A new view of mechanotransduction and strain amplification in cells with microvilli and cell processes. Biorheology. 2001;38:119-142.
61. Dupont S, Morsut L, Aragona M, et al. Papel de YAP/TAZ en la mecanotransducción. Nature .. 2011;474:179-183.
62. Zatti S, Zoso A, Serena E, et al. Micropatterning topology on soft substrates affects myoblast proliferation and differentiation. Langmuir. 2012;28:2718-2726.
63. Chowdhury F, Li Y, Poh YC, et al. Soft substrates promote homogeneous self-renewal of embryonic stem cells via downregulating cell-matrix tractions. PLoS One. 2010;5:e15655.
64. Huang C, Akaishi S, Ogawa R. Mechanosignaling pathways in cutaneous scarring. Arch Dermatol Res. 2012;304:589-597.
65. Ramselaar JA, Boot JP, van Haeringen NJ, et al. Corneal epithelial permeability after instillation of ophthalmic solutions containing local anaesthetics and preservatives. Curr Eye Res. 1988;7:947-950.
66. Burstein NL. Corneal cytotoxicity of topically applied drugs, vehicles and preservatives. Surv Ophthalmol. 1980;25:15-30.
67. Rosenwasser GO. Complications of topical ocular anaesthetics. Int Ophthalmol Clin. 1989;29:153-158.
68. Bisla K, Tanelian DL. Concentration-dependent effects of lidocaine on corneal epithelial wound healing. Invest Ophthalmol Vis Sci. 1992;33:3029-3033.
69. Krejci L, Harrison R. Antiglaucoma drug effects on corneal epithelium. A comparative study in tissue culture. Arch Ophthalmol. 1970;84:766-769.
70. Qu M, Wang Y, Yang L, et al. Different cellular effects of four anti-inflammatory eye drops on human corneal epithelial cells: independent in active components. Mol Vis. 2011;17:3147-3155.
71. Nguyen DQ, Srinivasan S, Hiscott P, et al. Thimerosal-induced limbal stem cell failure: report of a case and review of the literature. Lente de contacto ocular. 2007;33:196-198.
72. Zhou Y, Liu Q, Zhou T, et al. Modulation of the canonical Wnt pathway by Benzalkonium Chloride in corneal epithelium. Exp Eye Res. 2011;93:355-362.
73. Chen W, Li Z, Hu J, et al. Corneal alternations induced by topical application of benzalkonium chloride in rabbit. PLoS One. 2011;6:e26103.
74. Ye J, Wu H, Zhang H, et al. Role of benzalkonium chloride in DNA strand breaks in human corneal epithelial cells. Graefes Arch Clin Exp Ophthalmol. 2011;249:1681-1687.
75. Mason C, Dunnill P. Translational regenerative medicine research: essential to discovery and outcome. Regen Med. 2007;2:227-229.
Dr. Carmelo Chines
Director responsable






