Nueva confirmación de la validez del PHMB, actualmente en desarrollo para el tratamiento de la queratitis por Acanthamoeba.
Tras la designación europea (EU/3/07/498), la Food and Drug Administration (FDA) también reconoció la condición de medicamento huérfano (medicamento huérfano) con PHMB (polihexametilenbiguanida) para el tratamiento de la queratitis por Acanthamoeba, una enfermedad grave de la córnea causada por el protozoo Acanthamoeba spp.
La designación de PHMB como medicamento huérfano se concedió a la SIFI, la sociedad oftalmológica italiana que lidera la Proyecto ODAK (medicamento huérfano para la queratitis por acanthamoeba), un proyecto de investigación financiado por la Comisión Europea, cuyo objetivo es desarrollar un colirio a base de PHMB para el tratamiento eficaz y seguro de la queratitis por acanthamoeba.
La Queratitis por acanthamoeba es una enfermedad rara ("enfermedad huérfana"), que afecta a menos de 0,1 de cada 10.000 ciudadanos de la UE. Acanthamoeba es un protozoo microbiano con un ciclo vital que consta de dos fases principales: trofozoito y quiste. Mientras que el primero es sensible a los agentes quimioterapéuticos más comunes, el segundo es una forma inactiva que puede sobrevivir en condiciones ambientales extremas.
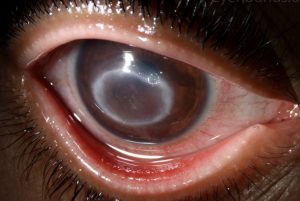
Los pacientes con queratitis por Acanthamoeba suelen experimentar dolor ocular intenso, fotofobia, enrojecimiento e irritación del ojo, visión borrosa y lagrimeo excesivo.
Los signos clínicos incluyen infiltrados estromales anulares, defectos epiteliales y edema palpebral. Los usuarios de lentes de contacto corren especial riesgo y representan hasta el 85 % de los casos de AC. Los pacientes suelen presentar formas muy graves de infección por Acanthamoeba y alrededor de 251 % de ellos tienen que recurrir al trasplante de córnea.
En Europa se está llevando a cabo un ensayo clínico multicéntrico. En el estudio clínico, se compara una solución de PHMB 0,08% con el tratamiento off-label más utilizado en la actualidad, consistente en PHMB 0,02% en combinación con Propamidina 0,01%. El estudio ya ha reclutado a 18 pacientes de un total de 130 y está previsto que concluya a finales de 2018.
Para más información, visite http://www.odak-project.eu/
Dr. Carmelo Chines
Director responsable
